从①盐析、②聚沉、③溶胶、④凝胶、⑤布朗运动、⑥电泳、⑦丁达尔效应、⑧中和、⑨水解中,选出适当的序号填入下列每小题后面的空格中:
(1)在浓肥皂水中加入饱和食盐水,肥皂凝聚,这种现象称为________。
(2)在肥皂水中透过强光,可见到光带,这种现象称为________。
(3)在肥皂水中加入酚酞变为红色,说明高级脂肪酸根离子发生了____________。
(4)在Fe(OH)3胶体中加入(NH4)2SO4,产生红褐色沉淀,这种现象叫做______________。
(5)在水泥厂和冶金厂常用高压电对气溶胶作用,除去大量烟尘,以减小对空气的污染。这种做法应用的主要原理是___________________________________________________。
已知A为生活中最常见金属,有以下物质相互转化
试回答:(1)写出B的化学式,D的化学式。
(2)写出由E转变成F的化学方程式。
(3)向G溶液加入A的有关离子反应方程式。
氯水中含有多种成分,因而具有多得性质,根据氯水分别与如图四种物质发生的反应填空(a、b、c、d重合部分代表物质间反应,且氯水足量)。能证明氯水具有漂白性的是(填“a”、“b”、“c”或“d”)。C过程中的现象是 ,b过程中的离子方程式为。a过程中的化学方程式为 。

有四种钠的化合物W、X、Y、Z,在一定条件下能发生如下反应(反应条件略):
① W X + CO2 + H2O;② Z + CO2
X + CO2 + H2O;② Z + CO2 X + O2;
X + O2;
③ Z + H2O Y + O2; ④ X + Ca(OH)2
Y + O2; ④ X + Ca(OH)2 Y + CaCO3
Y + CaCO3
⑴请根据以上反应式,写出下列物质的化学式:
W ,X ,Y ,Z 。
⑵除去W溶液中混有的少量X溶液的方法是(用化学方程式表示)。
(1)鉴别NaCl溶液和Na2CO3的试剂是 ,离子方程式为
(2)除去混入SiO2中少量Al2O3杂质的试剂是 ,离子方程式为
(3)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为
以下是有关物质相互转化的关系图,其中A俗称铁红,甲为强酸,乙为还原性气体,丙为强碱溶液,G为红褐色沉淀,I的颜色呈浅绿色。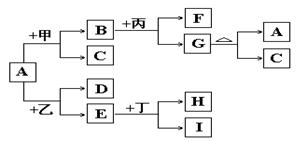
(1)若F是由Na+和SO42-组成的溶液,则甲的化学式是,列举A物质的一种用途。
(2)若D是能使澄清石灰水变浑浊的气体,则乙的化学式为 ,丁属于单质、酸、碱中的;在I溶液中加入氢氧化钠溶液,可以观察到的现象是,对应的离子方程式和化学方程式依次是,
;
(3)写出G A+C的化学方程式:。
A+C的化学方程式:。
(4)若A中混有杂质Al2O3,除去杂质的方法是加入过量的,该反应的离子方程式为。
(5)由E和A组成的混合物与稀H2SO4作用,固体恰好溶解,所得溶液中不含Fe3+,且生成的Fe2+与H2的物质的量之比为4:1。则反应物中Fe2O3、Fe、H2SO4的物质的量之比为________。