(6分)已知A、B、C是中学化学的常见物质,它们在一定条件下有如下转化关系: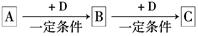
(1)若A能使湿润的红色石蕊试纸变蓝;C为红棕色气体。则A转化为B反应的化学方程式为 。
(2)若D是具有氧化性的单质,A元素属于短周期主族金属元素,则C 的电子式为 。
的电子式为 。
(3)若D是金属,C溶液在贮存时应加入少量D,其理由是(用必要的文字和离子方程式说明) 。
(4)若D是一种常见的温室气体;A是一种强电解质且在水溶液中电离出的阴、阳离子均含有10个电子。则B转化为C的离子方程式为 。
(5)若D为氯碱工业的主要产品,B具有两性,则C溶液中除氢氧根外还存在的阴离子的化学式为 。
(6)若A、B、C均为氧化物,D是一种黑色固态非金属单质,则B分子的结构式为 。
某溶液可能含有Clˉ、SO42ˉ、CO32ˉ、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确认其成分,取部分试液,设计并完成了如下实验: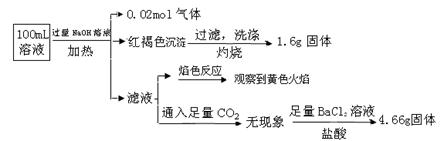
由此可知原溶液中
| A.原溶液中c(Fe3+)="0.2" mol·L-1 |
| B.溶液中至少有4种离子存在,其中Clˉ一定存在,且c(Clˉ)≥0.2 mol·L-1 |
| C.SO42ˉ、NH4+、Na+一定存在,CO32ˉ、Al3+一定不存在 |
| D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液成血红色,则含有Fe2+ |
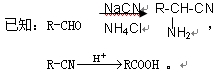
氯吡格雷(clopidogrel)是一种用于抑制血小板聚集的药物。以A(C7H5OCl)为原料合成氯吡格雷的路线如下: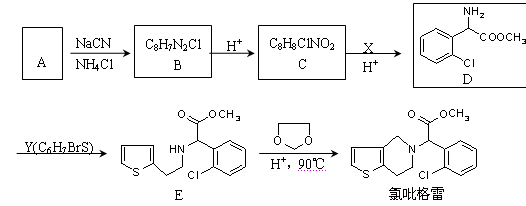
完成下列填空:
(1)C中含氧官能团的名称为,C→D的反应类型是。
(2)Y的结构简式为,在一定条件下Y与BrCl(一氯化溴,与卤素单质性质相似)按物质的量1:1发生加成反应,生成的产物可能有种。
(3)C可在一定条件下反应生成一种产物,该产物分子中含有3个六元环。该反应的化学
程式为。
(4)由E转化为氯吡格雷时,生成的另一种产物的结构简式为。
(5)写出A(芳香族化合物)的所有同分异构体的结构简式(包括A本身)。
(6)
写出由乙烯、甲醇为有机原料制备化合物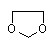 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
CH3CH2OH 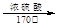 CH2=CH2
CH2=CH2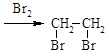
。
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中,X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是,属于区元素,它的外围电子的电子排布图为。
(2)XZ2分子的立体结构是,YZ2分子中Y的杂化轨道类型为,相同条件下两者在水中的溶解度较大的是(写分子式),理由是。
(3)含有元素N的盐的焰色反应为色,许多金属盐都可以发生焰色反应,其原因是。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。
铝生产产业链由铝土矿开采、氧化铝制取、铝的冶炼和铝材加工等环节构成。请回答下列问题:
(1)工业上采用电解氧化铝-冰晶石(Na3AlF6)熔融体的方法冶炼得到金属铝:
2Al2O3 4Al+3O2↑加入冰晶石的作用:_______________________________。
4Al+3O2↑加入冰晶石的作用:_______________________________。
(2)上述工艺所得铝材中往往含有少量Fe和Si等杂质,可用电解方法进一步提纯,该电解池中阳极的电极反应式为 ,下列可作阴极材料的是________________。
A.铝材 B.石墨 C.铅板 D.纯铝
(3)阳极氧化能使金属表面生成致密的氧化膜。以稀硫酸为电解液,铝阳极发生的电极反应式为__________________________________。
(4)在铝阳极氧化过程中,需要不断地调整电压,理由是____________。
(5)下列说法正确的是 。
A. 阳极氧化是应用原电池原理进行金属材料表面处理的技术
B. 铝的阳极氧化可增强铝表面的绝缘性能
C. 铝的阳极氧化可提高金属铝及其合金的耐腐蚀性,但耐磨性下降
D. 铝的阳极氧化膜富有多孔性,具有很强的吸附性能,能吸附染料而呈各种颜色
硅孔雀石是一种含铜的矿石,含铜形态为
 ,同时含有
,同时含有 等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
等杂质。以硅孔雀石为原料制取硫酸铜的工艺流程如下图:
请回答下列问题:
(1)完成步骤①中稀硫酸与 发生反应的化学方程式
发生反应的化学方程式 ;
;
用离子方程式表示双氧水的作用_____________________________。
(2)步骤②调节溶液pH选用的最佳试剂是__________________
A. |
B.CuO | C.A12O3 | D. |
(3)有关氢氧化物开始沉淀和完全沉淀的pH如下表:
由上表可知:当溶液pH=4时,可以完全除去的离子是______,不能完全除去的离子是________。
(4)滤液B通过蒸发浓缩(设体积浓缩为原来的一半)、冷却结晶可以得到 晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下,
晶体。某同学认为上述操作会拌有硫酸铝晶体的析出。请你结合相关数据对该同学的观点予以评价(已知常温下, 饱和溶液中
饱和溶液中 mol
mol ______________。
______________。
(5)若要测定硫酸铜晶体中结晶水的含量,需要的仪器是酒精灯、托盘天平、三角架、泥三角、玻璃棒、干燥器、坩埚钳、研钵、药匙、_________________。实验过程中硫酸铜晶体加热失水后在空中冷却后称量,则测定结果______________(填“偏高”、 “偏低”或“不变”)。