某学生利用下面实验装置探究盐桥式原电池的工作原理(Cu元素的相对原子质量为64)。

 按照实验步骤依次回答下列问题:
按照实验步骤依次回答下列问题:
(1)写出装置中锌电极上的电极反应式: ;
(2)若装置中铜电极的质量增加0.64g,则导线中转移的电子数目为 ;
(用“NA”表示)
(3)装置中盐桥中除添加琼脂外,还要添加KCl的饱和溶液,电池工作时,对盐桥中的
K+、Cl-的移动方向表述正确的是 。
A. 盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
B. 盐桥中的K+向右侧烧杯移动、Cl-向左侧 烧杯移动
烧杯移动
C. 盐桥中的K+、Cl-都向右侧烧杯移动
D.盐桥中的K+、Cl-几乎都不移动
(4)若ZnSO4溶液中含有杂质Cu2+,会加速Zn电极的腐蚀、还可能导致电流在较短时间内衰减。欲除去Cu2+,最好选用下列试剂中的 (填代号)。
A. NaOH B. Zn C. Fe D. H2SO4
【化学——选修2化学与技术】(15分)
(一)下列叙述正确的是()
| A.合成氨的“造气”阶段会产生废气 |
| B.电镀的酸性废液用碱中和后就可以排放 |
| C.电解制铝的过程中,作为阳极材料的无烟煤不会消耗 |
| D.使用煤炭转化的管道煤气比直接燃煤可减少环境污染 |
(二)工业生产Na2S常用方法是无水芒硝(Na2SO4)一碳还原法,其流程示意图如下:
(1)若煅烧阶段所得气体为等物质的量的CO和CO2。写出煅烧时发生的总反应方程式:。
(2)用碱液浸出产品比用热水更好,理由是。
(3)废水中汞常用硫化钠除去,汞的除去率与溶液pH和硫化钠实际用量与理论用量比值x的关系如图所示。
为使除汞达到最佳效果,应控制条件是。
(4)取Na2S(含少量NaOH),加入到CuSO4溶液中,充分搅拌,若反应后溶液pH=4,此时溶液中c(S2-)=mol·L-1。
[已知:CuS的Ksp=8.8×10-36;Cu(OH)2的Ksp=2.2×10-20(保留2位有效数字)]。
(5)纳米Cu2O常用电解法制备,制备过程用铜棒和石墨棒做电极,Cu(NO3)2做电解液。电解生成Cu2O应在;该电极pH将(填“升高”“不变”或“降低”),用电极方程式解释pH发生变化的原因。
(15分)氮的氢化物NH3、N2H4等在工农业生产、航空航天等领域有广泛应用。
(1)已知25℃时,几种难溶电解质的溶度积如下表所示:
| 氢氧化物 |
Cu(OH)2 |
Fe(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
| Ksp |
2.2×10-20 |
4.0×10-38 |
8.0×10-16 |
1.8×10-11 |
向Cu2+、Mg2+、Fe3+、Fe2+浓度都为0.01mol·L-1的溶液中缓慢滴加稀氨水,产生沉淀的先后顺序为(用化学式表示)。
(2)实验室制备氨气的化学方程式为。
工业上,制备肼(N2H4)的方法之一是用次氯酸钠溶液在碱性条件下与氨气反应。以石墨为电极,将该反应设计成原电池,该电池的负极反应为。
(3)在3 L密闭容器中,起始投入4 mol N2和9 mol H2在一定条件下合成氨,平衡时仅改变温度测得的数据如表所示:
| 温度(K) |
平衡时NH3的物质的量(mol) |
| T1 |
2.4 |
| T2 |
2.0 |
已知:破坏1 mol N2(g)和3 mol H2(g)中的化学键消耗的总能量小于破坏2 mol NH3(g)中的化学键消耗的能量。
①则T1T2(填“>”、“<”或“=”)。
②在T2 K下,经过10min达到化学平衡状态,则0~10min内H2的平均速率v(H2)=,平衡时N2的转化率α(N2)=。若再增加氢气浓度,该反应的平衡常数将(填“增大”、“减小”或“不变”)。
③下列图像分别代表焓变(△H)、混合气体平均相对分子质量( )、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是。
)、N2体积分数φ(N2)和气体密度(ρ)与反应时间关系,其中正确且能表明该可逆反应达到平衡状态的是。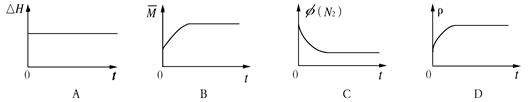
(14分)亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3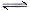 H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
H++ H2PO3-。亚磷酸与足量NaOH溶液反应,生和Na2HPO3。
(1)①写出亚磷酸与少量NaOH溶液反应的离子方程式。
②根据亚磷酸(H3PO3)的性质可推测Na2HPO3稀溶液的pH7(填“>”、“<”或“=”)。
③某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+)=2.5×10-2mol·L-1,除OH—之外其他离子的浓度由大到小的顺序是,该温度下H3PO3电离平衡的平衡常数K=。(H3PO3第二步电离忽略不计,结果保留两位有效数字)
(2)亚磷酸具有强还原性,可使碘水褪色,该反应的化学方程式。
(3)电解Na2HPO3溶液也可得到亚磷酸,装置示意图如下:
说明:阳膜只允许阳离子通过,阴膜只允许阴离子通过。
①阴极的电极反应式为。
②产品室中生成亚磷酸的离子方程式为。
【化学—选修5:有机化学基础】以下是合成香料香豆素的路径图: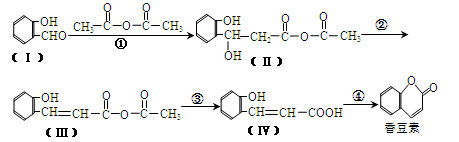
(1)香豆素的分子式为。
(2)Ⅰ与H2反应生成邻羟基苯甲醇,邻羟基苯甲醇的结构简式为。
(3)反应②的反应类型是。
(4)反应④的化学方程式是。
(5)Ⅴ是Ⅳ的同分异构体,Ⅴ的分子中含有苯环且无碳碳双键,苯环上含有两个邻位取代基,且能够发生酯化反应和银镜反应。Ⅴ的结构简式为。
(6)一定条件下,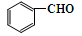 与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为。
与CH3CHO两者之间能发生类似①、②的两步反应,则生成有机物的结构简式为。
【化学——选修3:物质结构与性质】过渡金属元素铁能形成多种配合物,如:K3[Fe(SCN)6][硫氰合铁(Ⅲ)酸钾]和Fe(CO)x等。
(1)①基态Fe3+的M层电子排布式为。
②请解释+3价铁的化合物较+2价铁的化合物稳定的原因。
(2)配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则 x =。
(3)FeBr2为只含有离子键的离子化合物,其晶胞结构如图a,距一个Fe2+离子最近的所有Br-离子为顶点构成的几何体为。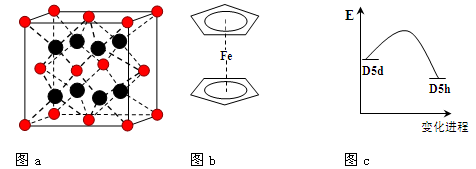
(4)二茂铁是最重要的金属茂基配合物,也是最早被发现的夹心配合物,包含两个环戊二烯基与铁原子成键。二茂铁的结构为一个铁原子处在两个平行的环戊二烯基环的之间,结构如图b所示,已知二茂铁的一氯代物只有一种。
①二茂铁的分子式为。
②穆斯堡尔谱学数据显示,二茂铁中心铁原子的氧化态为+2,每个茂环带有一个单位负电荷。因此每个环含有个π电子。
③二茂铁中两个茂环可以是重叠的(D5h),也可以是错位的(D5d),它们之间的能垒仅有8 ~ 20 kJ/mol。温度升高时则绕垂直轴相对转动,使得两种结构可以相互转换,转换过程中能量变化如图c。比较稳定的
是结构(填“重叠”或“错位”)。