有机物A的结构简式是 ,它可以通过不同的反应得到下列物质:
,它可以通过不同的反应得到下列物质:
B. C.
C.
D. E.
E.
(1)A中含氧官能团的名称: ;
(2)写出由A制取B的化学方程式: ;
(3)写出A制取C、D、E三种物质的有机反应类型:
C D E ;
(4)写出两种既可以看做酯类又可以看做酚类,且分子中苯环上连有三种取代基的A的同分异构体的结构简式(要求这两种同分异构体分子中苯环上的取代基至少有一种不同):
、
下图表示各物质之间的转化关系。已知:A、D、F、H均为单质,X常温下为无色液体,B为淡黄色固体,J溶于酸得到黄色溶液。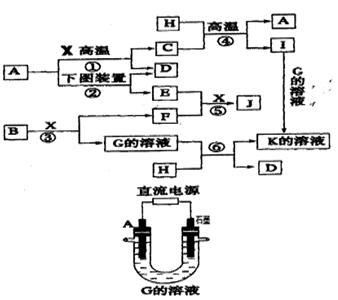
请按要求填空:
(1)反应⑤的现象是。反应③中若转移3NA电子,则被氧化的B是mol
(2)反应①的化学方程式是,在实验室中引发反应④的操作是。
(3)实验室用上图中的电解池制备E,与A相连的直流电源的电极名称为
A电极的电极反应式,下列溶液能代替G溶液的是。
A.稀硫酸 B.NaCl溶液 C.K2CO3溶液 D.CuCl2溶液
(4)现有J与稀硝酸恰好完全后的溶液
①在上述溶液中加入少量HI溶液的离子方程式为
②若要从上述溶液中得到晶体,正确的操作为:先,再降温结晶,过滤即可得所需晶体。
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HC1挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题。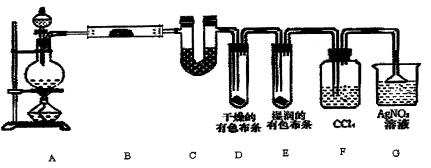
(1)若用含有0.2 mol HC1的浓盐酸与足量的MnO2反应制Cl2,制得的Cl2体积(标准状况下)总是小于1.12L的原因是。
(2)①装置B中盛放的试剂名称为,作用是。
装置C中盛放的试剂名称为,作用是 。
。
②装置D和E中出现的不同现象说明的问题是。
③装置F的作用是____。
④写出装置G中发生反应的离子方程式。
(3)乙同学认为甲同学的实验有缺陷,不能确保最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液的气体只有一种,乙同学提出在某两个装置之间再加一个装置。你认为该装置应加在与之间(填装置字母序号),装置中应放入(填写试剂或用品名称)
高中化学学习阶段,氨的催化氧化反应也可用某金属M(相对原子质量<100)的氧化物做催化剂。M元素的离子在一定条件下能与NH3、卤离子等按某固定比例牢牢结合成稳定的配合物离子(类似于原子团)。
(1)150℃、常压下,6.08g该氧化物与0.6mol HCl气体充分发生复分解反应后,氧化物无剩余,气体变为0.48mol。该金属M的相对原子质量为___________。
将上述反应所得固体溶于水配成50.0mL溶液,该溶液中溶质的物质的量浓度为
_______mol·L-1。
(2)取(1)中所配溶液12.5mL,稀释至25mL,缓缓通入2688mL氨气(标况下),在一定条件下反应恰好完全,得到产物B(摩尔质量为260.5g/mol),继续用1.5mol/L的AgNO3溶液滴定,达到终点时,耗去AgNO3溶液40.0mL。将B投入过量烧碱溶液中,未检测出NH3的逸出。则B的化学式可表示为。
(3)已知在下图中,L的位置完全相同。现有另一种配离子[M(NH3)6-xClx]n±(1≤x≤5,且x为整数),结构类似下图。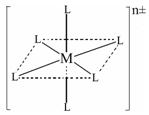
如果该配离子共有2种不同结构,该配离子的式量为。
(4)一定条件下,3.04g该金属氧化物恰好被某氧化剂(效果相当于0.03mol O2)氧化,再加入0.05mol KCl,经一些特殊工艺处理,K、M两元素恰好完全形成含氧酸盐(式量<360),且盐内部阴阳离子个数比为1:2。则该盐的式量以及物质的量分别为_______________。
A、B、C、D、E、F、G、H、I、J 均为有机化合物,其转化关系如下图所示。已知B 和 C 均为有支链的有机化合物;C在反应③中只能生成一种有机产物;G 能使溴的四氯化碳溶液褪色。回答问题:
能使溴的四氯化碳溶液褪色。回答问题:
(1)G的结构简式:____________________。⑦的反应类型____________________。
(2)步骤⑤的化学方程式 ______________________________________________。
(3)A在隔绝加热条件下可发生消去反应得到D ,请写出该消去反应中除D外的另一个产物的结构简式__________________________。
,请写出该消去反应中除D外的另一个产物的结构简式__________________________。
(4)步骤④中的“Cl2、光”能否改为“饱和氯水”?请说明原因:__________
(5)写出与H 具有相同官能团的同分异构体的结构简式______________________
(6)在一定条件下,酯与醇会发生酯交换,生成新的酯和醇。请尝试书写I与F发生的酯交换反应方程式:_____________________________________________________。
(7)一定条件下,G和H发生1:1聚合,聚合产物有多种。写 出其中两种聚合产物的结构简式:____________________________________________________________。
出其中两种聚合产物的结构简式:____________________________________________________________。
已知烃基烯基醚水解反应:R-CH=CH-O-R′ 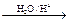 R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题:
R-CH2CHO + R′OH。烃基烯基醚A的式量为176,分子中碳氢原子数目比为3∶4 。有机物B的式量为60。相关的反应如下。请回答下列问题: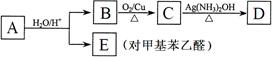
⑴ A的结构简式为________________________,B的名称是___________________。
⑵写出B → C反应的化学方程式:________________ _______________________。
_______________________。
⑶写出两种符合下列条件的E的同分异构体的结构简式:__ ___________________。
___________________。
① 属于芳香醛; ② 苯环上有两种不同的氢原子。
⑷由E转化为对甲基苯乙炔(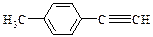 )的一条路线如下:
)的一条路线如下: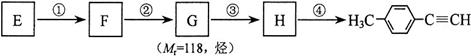
(I)写出G的结构简式:_____________________________。
(II)步骤②所加试剂及反应条件为:____________。步骤④的反应类型为:________。