下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。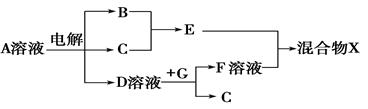
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
现有反应:mA(g)+nB(g) pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1)该反应的逆反应为_________热反应,且m+n_________p(填“>”“=”“<”)。
(2)减压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入B(体积不变),则A的转化率_________,B的转化率_________。
(4)若升高温度,则平衡时B、C的浓度之比将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量_________。
(6)若B是有色物质,A、C均无色,则加入C(体积不变)时混合物颜色_______,而维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
一定温度下将3molA和1molB气体通入体积为2L的密闭恒容容器中,发生反应3A(g)+ B(g) xC(g)2min时反应平衡,剩余0.8molB,并测得C的浓度为0.4mol/L.
xC(g)2min时反应平衡,剩余0.8molB,并测得C的浓度为0.4mol/L.
回答问题
(1)从开始反应到达平衡,生成C的平均反应速率为________________
(2) x=________________
(3)若继续向原平衡混合物的容器中通入少量氦气,化学平衡___________(填字母)
A.向正反应方向移动
B. 向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入amolC,在原温度下达新的平衡,此时B的物质的量 n(B)=_______________mol
工业上用铝土矿(含氧化铝、氧化铁)制取铝的过程如下: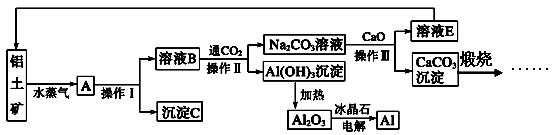
请回答下列问题:
(1)沉淀C的化学式为________,该物质用途除了用于金属冶炼以外,还可用作________。
(2)生产过程中,除NaOH、H2O可以循环使用外,还可以循环使用的物质有________(填化学式)。用此法制取铝的副产品是________(填化学式)。
(3)操作Ⅰ、操作Ⅱ和操作Ⅲ都是________(填操作名称),实验室要洗涤Al(OH)3沉淀应该在________装置中进行,洗涤方法是____________________________________
___________________________________________________________________。
(4)电解熔融的氧化铝时,若得到标准状况下22.4 L O2,则同时生成铝的质量为________。
(5)写出Na2CO3溶液与CaO反应的离子方程式:_______________________________。
汽油不仅是重要的燃料,而且是重要的化工原料。它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,回答下列问题: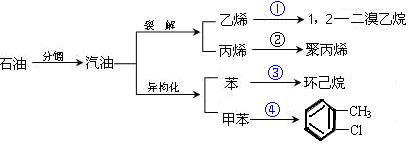
(1)写出反应②和③的化学方程式
________________________________;___________________________________
(2)①④的反应类型分别是_____________、_________________
(3)四氟乙烯(CF2=CF2)在一定条件下发生聚合反应,生成的聚四氟乙烯可做“不粘锅” 炊具的内涂层。下列叙述正确的是
| A.聚四氟乙烯中不含碳碳双键,在高温时容易燃烧 |
| B.聚四氟乙烯是高分子化合物 |
| C.聚四氟乙烯的化学性质很稳定,正常使用时几乎不会发生化学变化 |
| D.由于氟是最活泼的非金属元素,故四氟乙烯不会发生任何化学变化 |
E.取等质量的乙烯和聚乙烯,完全燃烧,生成的CO2和H2O的物质的量分别相等
F.四氟乙烯和聚四氟乙烯都属于纯净物
下图表示4个碳原子相互结合的方式。小球表示碳原子,小棍表示化学键,假如碳原子上其余的化学键都是与氢结合。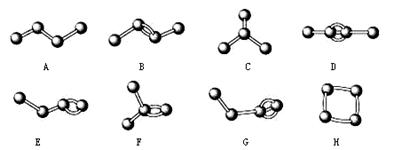
(1)图中与甲烷互为同系物的是(填编号)
(2)上图中互为同分异构体的是:B与;D与。(填编号)