研究有机物一般经过以下几个基本步骤:分离、提纯 → 确定实验式 → 确定分子式 → 确定结构式。
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空: (1)A的相对分子质量为 。 |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。 |
(2)A的分子式为 。 |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。 |
(3)用结构简式表示A中含有的官能团 。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有 种氢原子。 综上所述, A的结构简式为 。 |
实验室用氯化钠固体配制1.00 mol/L的NaCl溶液0.5 L,回答下列问题:
(1)请写出该实验的实验步骤:
①,②,③,④,⑤,⑥。
(2)所需仪器为:托盘天平、还需要那些实验仪器才能完成该实验,请写出:。
(3)试分析下列操作对所配溶液的浓度有何影响及造成该影响的原因。
定容后,加盖倒转摇匀后,发现液面低于刻度线,又滴加蒸馏水至刻度。对所配溶液浓度的影响:,原因是:。
就有关物质的分离回答下列问题:
(1)现有一瓶A和B的混合液,已知它们的性质如下表。
| 物质 |
熔点/℃ |
沸点/℃ |
密度/g·cm-3 |
溶解性 |
| A |
-11.5 |
198 |
1.11 |
A、B互溶,且均易溶于水 |
| B |
17.9 |
290 |
1.26 |
据此分析,将A和B相互分离的常用方法是:。
(2)在分液漏斗中用一种有机溶剂提取水溶液里的某物质时,静置分层后,如果不知道哪一层液体是“水层”,试设计一种简便的判断方法:。
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,是氧化剂,是还原剂,元素被氧化,元素被还原,若0.3mol氯气生成则若0.3mol氯气生成转移的电子数目为。
在300 mL2mol/LH2SO4溶液中,溶质的质量是,此溶液中含H+的物质的量是,H+的物质的量浓度是,其中含有个SO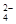 ,SO
,SO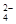 的物质的量浓度是。
的物质的量浓度是。
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答: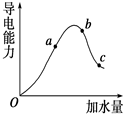
(1) “O”点为什么不导电________.
(2)a,b,c三点的pH由小到大的顺序是____________.
(3) a、b、c三点中电离程度最大的是
电离平衡常数Ka、Kb、Kc的大小关系为________.
(4)若使c点溶液中的c(CH3COO-)增大,可以采取下列措施中的 ________(填序号).
A加热;B加很稀的NaOH溶液;C加NaOH固体;D加水;E加固体CH3COONa;F加入锌粒