(5分) 有W、X、Y、Z四种短周期元素,它们的核电荷数依次增大; W元素原子是所有原子中半径最小的; X元素原子L层电子数是K层电子数的3倍, Y元素原子的最外层电子数与电子层数相同;Z元素原子的最外层电子数比次外层少1。由此可知:
(1)写出它们的元素符号W_______X______Y_______Z________.
(2)X在元素周期表中的位置是 _________ 。
某温度下,将Fe(OH)3(s)、Cu(OH)2(s) 分别置于蒸馏水中达到沉淀溶解平衡后,金属阳离子浓度随溶液 的变化如图所示。下列判断正确的是
的变化如图所示。下列判断正确的是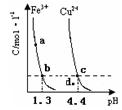
A.加适量浓NH3·H2O可使溶液由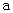 点变到 点变到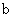 点 点 |
B.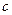 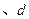 两点代表的溶液中 两点代表的溶液中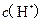 与 与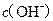 乘积不相等 乘积不相等 |
C.Cu(OH)2在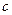 点比在d点代表的溶液中溶解程度小 点比在d点代表的溶液中溶解程度小 |
D.该温度下,氢氧化铁的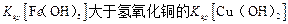 |
已知A、B、C是单质,其中C是绿色植物光合作用的产物之一,X、Y是化合物,它们之间的转化关系如图(反应条件略),下列判断不正确的是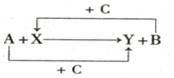
A.A 是铝,B是铁 B.A 是碳,B是硅
C.A 是氢气,B是铜 D.A 是钠,B是氢气
下列说法正确的是
| A.苯能使酸性KMnO4溶液褪色 | B.汽油、柴油和植物油都是碳氢化合物 |
| C.乙酸和油脂都能与氢氧化钠溶液反应 | D.苯在工业上主要是通过石油分馏得到 |
硫代硫酸钠(Na2S2O3)俗称大苏打,主要用于照相业作定影剂。Na2S2O3易溶于水,在酸性溶液中会迅速分解,具有较强的还原性。
(1)Na2S2O3溶液与足量氯水反应的离子方程式为______________________________________。(S元素被氧化为SO42-)
(2)硫代硫酸钠(Na2S2O3)露置在空气中易氧化变质,其可能的变质后生成物如下:
假设一:
假设二:只有Na2SO4固体
假设三:
(3)现有一瓶Na2S2O3固体,可能混有Na2SO4固体。设计实验验证该假设,写出实验步骤、预期现象和结论。限选试剂: 1mol·L-1 H2SO4、1mol·L-1HNO3、1mol·L-1HCl、1mol·L-1NaOH、0. 1 mol·L-1BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
1 mol·L-1BaCl2、0.01 mol·L-1 KMnO4、蒸馏水。
| 实验步骤 |
预期现象和结论 |
| 步骤1:取少量固体于试管中,加蒸馏水溶解。 |
|
| 步骤2: |
|
| 步骤3: |
镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程:
请回答:
(1)MgCl2•6H2O溶于水,溶液呈(填“酸性”、“中性”、或“碱性”)。
(2)蒸氨是将石灰乳通入氯化铵溶液中,并加热,写出该反应的化学方程式:。
(3)轻烧后的产物为。
(4)如何检验沉淀已洗涤干净的方法是。
(5)氨化反应过程中反应的离子方程式为。
(6)已知向Mg(OH)2沉淀中滴加氯化铵溶液可观察到沉淀溶解,试解释该反应发生的原理(用离子方程式表示和文字说明)。