(1)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,其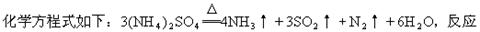
成的氧化产物与还原产物分子个数之比为_______________。
(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,(2)加入Na2CO3,有气泡产生,由此可判断出该钠盐A为___________(化学式),写出有关离子方程式_____________________________,____________________________________。
钢铁容易生锈的主要原因是因为钢铁在炼制过程中混有少量的碳杂质,在潮湿的空气中容易形成原电池,发生电化学腐蚀。在空气酸度不大的环境中,其负极是,负极反应式为;正极是,正极反应式为。
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
已知下列热化学方程式:
①H2(g)+1/2O2(g)=H2O(l)ΔH=" —285" kJ/mol
②H2(g)+1/2O2(g)=H2O(g)ΔH=" —241.8" kJ/mol
③C(s)+1/2O2(g)="CO(g)" ΔH=" —241.8" kJ/mol
④C(s)+O2(g)=CO2(g)ΔH=" —393.5" kJ/mol
回答下列问题:
(1)上述反应中属于放热反应的是_________________。
(2)H2的燃烧热为___________;C的燃烧热为___________。
(3)燃烧10 g H2生成液态水,放出的热量为__________________。
(4)CO的燃烧热为______________,其热化学方程式为______________________。
在KClO3 + 6HCl(浓) =" KCl" + 3Cl2↑ + 3H2O的反应中,氧化剂是___________,还原产物是_________,得电子与失电子个数比是____________,氧化产物与还原产物的质量比是______,试用双线桥标出反应电子转移的方向和数目_________________________
(1)将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组。
A组显酸性,除H+ 外还有、、离子
B组显碱性,除OH-外还有、、离子
(2)实验室制备氢氧化铁胶体的方法是;
反应的化学方程为。