下图虚线框中的装置可用来检验浓硫酸与木炭粉在加热条件下反应产生的所有气体产物。填写下列空白。
(1)如果将装置中①、②、③三部分仪器的连接顺序变为②、①、③,则可以检出的物质是_______,不能检出的物质是________。
(2)如果将仪器的连接顺序变为①、③、②,则可以检出的物质是_____,不能检出的物质是_________。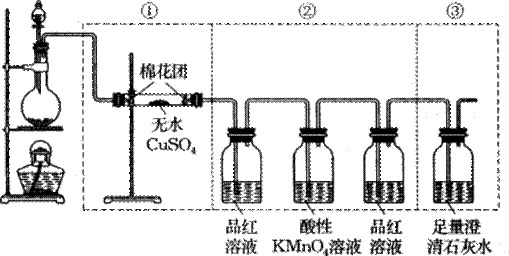
(3)如果将仪器的连接顺序变为②、③、①,则可以检出的物质是______,不能检出的物质是_________。
(4)写出浓硫酸与木炭粉在加热条件下反应的化学方程式 。
淀粉水解的产物(C6H12O6)用硝酸氧化可以制备草酸,装置如图所示(加热、搅拌和仪器固定装置均已略去):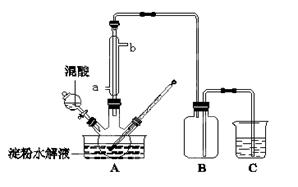
实验过程如下:
①将1∶1的淀粉水乳液与少许硫酸(98%)加入烧杯中,水浴加热至85℃~90℃,保持30 min,然后逐渐将温度降至60℃左右;
②将一定量的淀粉水解液加入三颈烧瓶中;
③控制反应液温度在55~60℃条件下,边搅拌边缓慢滴加一定量含有适量催化剂的混酸(65%HNO3与98%H2SO34的质量比为2:1.5)溶液;
④反应3h左右,冷却,减压过滤后再重结晶得草酸晶体。硝酸氧化淀粉水解液过程中可发生下列反应:
C6H12O6+12HNO3→3H2C2O4+9NO2↑+3NO↑+9H2O
C6H12O6+8HNO3→6CO2+8NO↑+10H2O
3H2C2O4+2HNO3→6CO2+2NO↑+4H2O
请回答下列问题:
(1)实验①加入98%硫酸少许的作用是:。
(2)实验中若混酸滴加过快,将导致草酸产量下降,其原因是。
(3)检验淀粉是否水解完全所用的试剂为。
(4)草酸重结晶的减压过滤操作中,除烧杯、玻璃棒外,还必须使用属于硅酸盐材料的仪器有。
(5)将产品在恒温箱内约90℃以下烘干至恒重,得到二水合草酸。用KMnO4标准溶液滴定,该反应的离子方程式为:
2MnO4- + 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O称取该样品0.12 g,加适量水完全溶解,然后用0.020 mol·L-1的酸性KMnO4溶液滴定至终点(杂质不参与反应),此时溶液颜色变化为。滴定前后滴定管中的液面读数如图所示,则该草酸晶体样品中二水合草酸的质量分数为。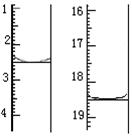
已知下表数据:
| 物质 |
熔点/℃ |
沸点/℃ |
密度/(g/cm3) |
| 乙醇 |
-144 |
78 |
0.789 |
| 乙酸 |
16.6 |
117.9 |
1.05 |
| 乙酸乙酯 |
-83.6 |
77.5 |
0.90 |
| 浓硫酸 |
—— |
338 |
1.84 |
某学生做乙酸乙酯的制备实验
(1)写出该反应的化学反应式。
(2)按装置图安装好仪器后,将在大试管中配制好体积比为3︰2的乙醇和乙酸混合溶液与浓硫酸混合时的操作要点是。
(3)根据上表数据分析,为什么乙醇需要过量一些,其原因是。
按正确操作重新实验,该学生很快在小试管中收集到了乙酸乙酯、乙酸、乙醇的混合物。现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,下图是分离操作步骤流程图。在图中圆括号表示加入适当的试剂,编号表示适当的分离方法。
(4)写出加入的试剂:试剂(a)是;试剂(b)是。
(5)写出有关的操作分离方法:①是,②是,③是。
某学生利用锌与稀硫酸反应产生的氢气的体积,粗略测定锌的摩尔质量(设Wg锌片全部反应,产生气体的体积折算成标准状况时不超过50mL)。实验装置如下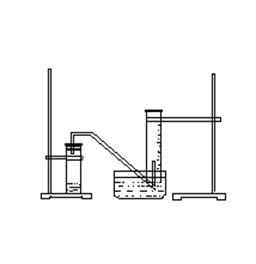
请回答:(1)进行此实验时,必须保证气密性良好,如何检验此装置的气密性?
______________________________________________________________________________________________________________________________________________
(2)以下是测量收集到气体体积必须包含的几个步骤:a.调整量筒内外液面高度使之相同;b.使试管和量筒内的气体都冷却至室温;c.读取量筒内气体的体积。这三个操作步骤的正确顺序是(填写代号) _____________________。
测量收集到气体体积时,如何使量筒内外液面的高度相同?
_____________________________________________________________________
进行该操作的目的是___________________________________________
如果实验中得到的氢气体积是VmL(已折算成标准状况),水蒸气的影响忽略不计
锌的摩尔质量的计算式为(含W、V,不必化简):M(Zn)= _______________________
甲乙两位同学分别用不同的方法配制100mL 3.6mol/L的稀硫酸。
(1)若采用18mol/L的浓硫酸配制溶液,需要用到浓硫酸的体积为_________ 。
(2)甲学生:量取浓硫酸,小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL 容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是
______________________________________________________________________________。
②洗涤操作中,将洗涤烧杯后的洗液也注入容量瓶,其目的是
______________________________________________________________________。
③定容的正确操作是
______________________________________________________________________。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填序号)。
| A.吸出多余液体,使凹液面与刻度线相切 |
| B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切 |
| C.经计算加入一定量的浓盐酸 |
| D.重新配制 |
(3)乙学生:用100 mL 量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL 刻度线,再搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处
____________________________________________________________________________
用质量分数为98%、密度为1.84g/cm3的浓硫酸配制100mL1.84mol/L的稀硫酸,若实验仪器有:
| A.100mL量筒 | B.托盘天平 |
| C.玻璃棒 | D.50mL容量瓶 |
E.10mL量筒 F.胶头滴管
G.50mL烧杯 H.100mL容量瓶
实验时应选用仪器的先后顺序是(填入编号):。