(本题共10分) 碱式碳酸铜【Cu2(OH)2CO3】是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
步骤一:废铜屑制硝酸铜:如图,用胶头滴管吸取浓HNO3缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。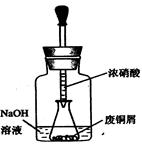
步骤二:碱式碳酸铜的制备:向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol/L的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
①.上图装置中NaOH溶液的作用是_ _。反应结束后,广口瓶内的溶液中,除了含有NaOH外,还有__ __(填写化学式)。
②步骤二中,水浴加热所需仪器有__ __、_ _(加热、夹持仪器、石棉网除外);
洗涤的目的是__ __。
③.步骤二的滤液中可能含有CO32-,写出检验CO32-的方法。
④.若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是__ __。
Fenton法常用于处理含难降解有机物的工业废水,通常是在调节好PH和Fe2+浓度的废水中加入H2O2,所产生的羟基自由基能氧化降解污染物。现运用该方法降解有机污染物p-CP,探究有关因素对该降解反应速率的影响。
[实验设计]控制p-CP的初始浓度相同,恒定实验温度在298K或313K(其余实验条件见下表),设计如下对比试验。
(1)请完成以下实验设计表(表中不要留空格)。
| 实验 编号 |
实验目的 |
T/K |
PH |
c/10-3mol·L-1 |
|
| H2O2 |
Fe2+ |
||||
| ① |
为以下实验作参考 |
298 |
3 |
6.0 |
0.30 |
| ② |
探究温度对降解反应速率的影响 |
||||
| ③ |
298 |
10 |
6.0 |
0.30 |
[数据处理]实验测得p-CP的浓度随时间变化的关系如右上图。
(2)请根据右上图实验①曲线,计算降解反应在50~150s内的反应速率:
v(p-CP)=" ______________" mol·L-1·s-1
[解释与结论]
(3)实验①、②表明温度升高,降解反应速率增大。但温度过高时反而导致降解反应速率减小,请从Fenton法所用试剂H2O2的角度分析原因:___________________。
(4)实验③得出的结论是:pH等于10时,_________________________________。
[思考与交流]
(5)实验时需在不同时间从反应器中取样,并使所取样品中的反应立即停止下来。根据上图中的信息,给出一种迅速停止反应的方法:
.。
我国规定饮用水质量标准必须符合下列要求:
| pH |
6.5~8.5 |
| Ca2+、Mg2+总浓度 |
<0.0045 mol·L-1 |
| 细菌总数 |
<100个·mL-1 |
以下是源水处理成自来水的工艺流程示意图:
(1)源水中含Ca2+、Mg2+、HCO-、Cl-等,加入石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个离子方程式______________________。
(2)凝聚剂除去悬浮固体颗粒的过程是_____________(填写编号)
①只是物理过程②只是化学过程③是物理和化学过程
FeSO4·7H2O是常用的凝聚剂,它在水中最终生成_____________沉淀。
(3)通入CO2的目的是____________________________和____________________。
(4)气体A的作用是____________________,这种作用是基于气体A和水反应的产物具有_______________________性。
(5)下列物质中,____________________可以作为气体A的代用品(填写编号,多选倒扣)。
①Ca(ClO)2②NH3 (l) ③K2FeO4④SO2
某固体混合物可能含有 、
、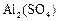 、
、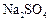 、
、 、
、 和
和 。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
。将该混合物进行如下实验,根据所给实验现象完成表格(对于能确定的物质在相应位置写化学式,暂不能确定的物质在相应位置填“无”) :.
(1)将少许混合物放入水中得到无色溶液和白色沉淀。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(2)取溶液进行焰色反应,火焰呈黄色。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(3)取白色沉淀加入稀盐酸,沉淀完全溶解并放出气体。
| 肯定存在的物质 |
肯定不存在的物质 |
理由 |
(4)通过上述实验仍无法确定的物质是。
下图是实验室制取Cl2并以Cl2为原料进行特定反应的实验: 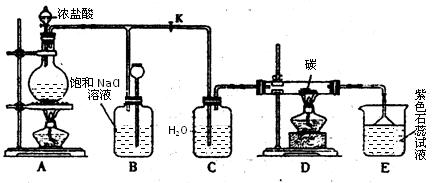
(1)A为氯气发生装置,写出反应的化学方程式________________________。
(2)实验开始先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处的酒精灯。Cl2通过C瓶后进入D,D装置内盛有碳粉,发生氧化还原反应,生成CO2和HCl,写出D装置中反应的化学方程式 _____;装置C的作用是 。
(3)E处石蕊试液的现象是_______________;其原因是__________________。
(4)若将E处溶液改为石灰水,反应过程的现象是_____________________________。
A.有白色沉淀生成
B.无白色沉淀生成
C.先生成白色沉淀,然后沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,由于余热的作用,A处仍有少量Cl2产生,此处B中的现象是________________,B的作用是________________。
[化学选修──有机化学基础]
根据图示回答下列问题:
(1)写出A、E、G的结构简式:A_____________,E_______________,G______________;
(2)反应②的化学方程式(包括反应条件)是_________________________,
(3)反应④化学方程式(包括反应条件)是______________________ ______________;
(4)写出①、⑤的反应类型:①________________、⑤__________________。