(14分)为测定某有机化合物A的结构,进行如下实验。
【分子式的确定】
⑴将有机物A置于氧气流中充分燃烧,实验测得:生成5.4gH2O和8.8gCO2,消耗氧气6.72L(标准状况下)。则该物质的实验式是 ;
⑵质谱仪测定有机物A的相对分子质量为46,则该物质的分子式是 ;
⑶预测A的可能结构并写出结构简式 。
【结构式的确定】
⑷核磁共振氢原子光谱能对有机物分子中不同 位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl―CH2―O―CH3)有两种氢原子(下左图)。经测定,有机物A的核磁共振氢谱图如下右图,则A的结构简式为 。
位置的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(Cl―CH2―O―CH3)有两种氢原子(下左图)。经测定,有机物A的核磁共振氢谱图如下右图,则A的结构简式为 。
【性质实验】
⑸A在一定条件下脱水可生成B,B可合成包装塑料C,请写出B转化为C的化学反应方程式: 。
⑹体育比赛中当运动员肌肉扭伤时,队医随即用氯乙烷(沸点为12.27℃)对受伤部位进行局部冷冻麻醉。请用B选择合适的方法制备氯乙烷,要求原子利用率为100%,请写出制备反应方程式: 。
⑺A可通过粮食在一定条件下制得,由粮食制得的A在一定温度下密闭储存,因为发生一系列的化学变化而变得更醇香。请写出最后一步反应的化学方程式: 。
某些资料认为:NO、NO2不能与Na2O2反应。某小组学生提出质疑,他们从理论上分析过氧化钠和二氧化氮都有氧化性,根据化合价升降原则提出假设:
假设Ⅰ.过氧化钠氧化二氧化氮
假设Ⅱ.二氧化氮氧化过氧化钠
(1)小组甲同学设计实验如下:
①试管A中反应的化学方程式是。
②待试管B中收集满气体,向试管B中加入适量 Na2O2粉末,塞紧塞子,轻轻振荡试管内粉末,观察到红棕色气体迅速消失;再将余烬木条迅速伸进试管内,看见木条复燃。甲同学认为假设Ⅱ正确;乙同学认为该装置不能达到实验目的,为达到实验目的,在A、B之间增加一个装置,该装置的作用是。
③乙同学用改进后装置,重复了甲同学的实验操作,观察到红棕色气体迅速消失;余烬木条未复燃。得出结论:假设Ⅰ正确。NO2和Na2O2反应的方程式是。
(2)丙同学认为NO易与O2发生反应,应更易被Na2O2氧化。
查阅资料:① 2NO+Na2O2=2NaNO2
②6NaNO2+3H2SO4=3Na2 SO4+ 2HNO3+4NO↑+2H2O;
③酸性条件下,NO或NO2–都能与MnO4–反应生成NO3–和Mn2+
丙同学用下图所示装置(部分夹持装置略)探究NO与Na2O2的反应。
①B中观察到的主要现象是,F装置的作用是。
②在反应前,打开弹簧夹,通入一段时间N2,目的是。
③充分反应后,检验D装置中发生反应的实验是。
Ullmann(乌尔曼)反应是偶联反应的一种,可以实现卤代苯与含氮杂环的反应。其反应机理如下:
(1)化合物II的分子式为 。
(2)化合物Ⅳ是化合物I的同系物,分子式为C8H9Br,且为苯的对二取代物,其核磁共振氢谱中共有4
组峰,峰的面积之比为3:2:2:2,其所有的结构简式为 、 。
(3)1mol化合物Ⅲ可以与 mol H2发生加成反应;加成后产物的结构简式为 。
(4)化合物Ⅳ的一种同分异构体V的结构简式为 ,V与氢氧化钠的醇溶液在加热条
,V与氢氧化钠的醇溶液在加热条
件下发生的化学反应方程式为 ;反应类型为 。
(5)一定条件下, 与
与 也可以发生Ullmann(乌尔曼)反应,参加反应的物质的量之比为2:1,则生成物的结构简式为 。
也可以发生Ullmann(乌尔曼)反应,参加反应的物质的量之比为2:1,则生成物的结构简式为 。
为了探究AgNO3的热稳定性,某化学兴趣小组设计了如下实验。用如图所示的实验装置A加热AgNO3固体,产生红棕色气体,在装置D中收集到无色气体。当反应结束后,试管中残留固体为黑色。
(1)装置B的作用是。
(2)经小组讨论并验证该无色气体为O2,其验证方法是。
(3)【查阅资料】Ag2O和粉末状的Ag均为黑色;Ag2O可溶于氨水。
【提出设想】试管中残留的黑色固体可能是:ⅰ.Ag;ⅱ.Ag2O;ⅲ.Ag和Ag2O。
【实验验证】该小组为验证上述设想,分别取少量黑色固体放入试管中,进行了如下实验。
| 实验编号 |
操作 |
现象 |
| a |
加入足量氨水,振荡 |
黑色固体不溶解 |
| b |
加入足量稀硝酸,振荡 |
黑色固体溶解,并有气体产生 |
【实验评价】根据上述实验,不能确定固体产物成分的实验是(填实验编号)。
【实验结论】根据上述实验结果,该小组得出AgNO3固体热分解的产物有。
某研究性学习小组设计两套实验方案制备氨气并探究其还原性(部分夹持装置已省略)。
甲方案:如图所示。
乙方案:如图所示。
根据方案回答下列问题:
(一)甲方案
(1)B装置盛装碱石灰,A装置中药品可以是。
a.氯化铵固体和烧碱 b.碳酸氢铵固体
c.氯化铵固体 d.硫酸铵和熟石灰
(2)实验完毕后,设计简单实验检验D试管收集到的物质(简述操作过程、现象和结论)。
(3)写出C中发生反应的化学方程式。
(二)乙方案
(4)A为浓氨水,B为生石灰,简述实验原理:。E装置里盛装的药品是。
(5)能证明氨气具有还原性的实验现象。(任写两条)
(6)铜有+2价、+1价、0价,根据氧化还原反应原理,D玻璃管里还原产物除铜外,还可能有,假设有铜以外的还原产物生成,写出D中发生反应的化学方程式:。
正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。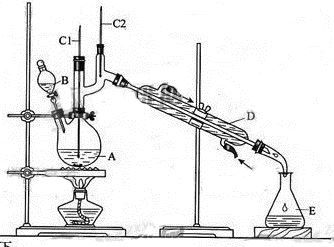
发生的反应如下: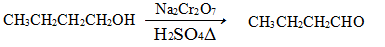
反应物和产物的相关数据列表如下:
| 沸点/℃ |
密度/(g·cm-3) |
水中溶解性 |
|
| 正丁醇 |
11.72 |
0.8109 |
微溶 |
| 正丁醛 |
75.7 |
0.8017 |
微溶 |
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加30mL水溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90—95℃,在E中收集90℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75—77℃馏分,产量2.0g。
回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由。
(2)加入沸石的作用是。若加热后发现未加沸石,应采取的正确方法是。
(3)上述装置图中,B仪器的名称是,D仪器的名称是。
(4)分液漏斗使用前必须进行的操作是(填正确答案标号)。
a.润湿 b.干燥 c.检漏 d.标定
(5)将正丁醛粗产品置于分液漏斗中分水时,水在层(填“上”或“下”)
(6)反应温度应保持在90—95℃,其原因是。
(7)本实验中,正丁醛的产率为%。