Ullmann(乌尔曼)反应是偶联反应的一种,可以实现卤代苯与含氮杂环的反应。其反应机理如下:

(1)化合物II的分子式为 。
(2)化合物Ⅳ是化合物I的同系物,分子式为C8H9Br,且为苯的对二取代物,其核磁共振氢谱中共有4
组峰,峰的面积之比为3:2:2:2,其所有的结构简式为 、 。
(3)1mol化合物Ⅲ可以与 mol H2发生加成反应;加成后产物的结构简式为 。
(4)化合物Ⅳ的一种同分异构体V的结构简式为 ,V与氢氧化钠的醇溶液在加热条
,V与氢氧化钠的醇溶液在加热条
件下发生的化学反应方程式为 ;反应类型为 。
(5)一定条件下, 与
与 也可以发生Ullmann(乌尔曼)反应,参加反应的物质的量之比为2:1,则生成物的结构简式为 。
也可以发生Ullmann(乌尔曼)反应,参加反应的物质的量之比为2:1,则生成物的结构简式为 。
31.某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭)。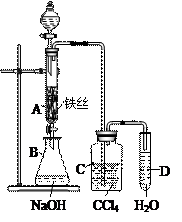
(1)写出A中反应的化学方程式:
(2)观察到A中的现象是:
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是:
(4)C中盛放CCl4的作用是
(5)证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是
现有36%的醋酸(CH3COOH),密度为1g/ml,欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸ml。需要使用的实验仪器有烧杯、量筒、玻璃棒、、
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 (填“正确”、“偏大”或“偏小”)。
(填“正确”、“偏大”或“偏小”)。
实验室用固体烧碱配制100 mL 1.0 mol·L-1的NaOH溶液。
| A.100 mL烧杯 | B.500 mL容量瓶 | C.玻璃棒 | D.100 mL容量瓶 E、漏斗 |
F、胶头滴管 G、试管 H、托盘天平 I、药匙 J、200 mL试剂瓶
(1)需称量_________ g 烧碱,应放在___________中(填写代号)称量、溶解。
(2)完成此配制实验,需要用的仪器(填写代号)___________________
实验室配制500mL 0.1mol/L的NaOH溶液,有如下操作步骤:
①计算所需NaOH固体的质量并用托盘天平称取;
②将称量好的NaOH固体放入烧杯中,加入适量的蒸馏水溶解;
③用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心转入容量瓶中并轻轻摇匀;
④继续向容量瓶中加蒸馏水至液面距刻度线1~2cm处,小心滴加蒸馏水至溶液凹液面与刻度线相切;
⑤塞紧容量瓶的塞子,充分摇匀。
回答下列问题:
(1)本实验中除用到容量瓶和烧杯外,还需要用到的玻璃仪器有:
。
(2)实验中用托盘天平实际称取NaOH固体的质量是。
(3)上述实验操作步骤缺少一步,请补充所缺步骤的位置及内容:
。
(4)在实验中,未进行操作④,所配溶液的浓度会(填“偏高”、“偏低”或“无影响”,下同);
定容时俯视液面,所配溶液的浓度会。
称量时已观察到NaOH吸水,所配溶液的浓度会。
(16分)双安妥明是一种降血脂药物,主要用于降低血液中胆固醇浓度,安全,副作用小,其结构简式为:
已知:
双安妥明的合成路线如下:
已知:C的摩尔质量是同温同压下氢气质量的28倍;I能发生银镜反应且1mol I能与2molH2S生加成反应;K的结构具有对称性。试回答下列问题:
(1)双安妥明的分子式为:_____________。
(2)E的结构简式为:________________________
(3)反应②的条件是__________________
(4)J与新制氢氧化铜发生反应的化学方程式为:__________________
(5)反应④的化学方程式为:______________________________
(6)符合下列3个备件的H的同分异构体有____________种,①能与FeCl3溶液显色;②苹环上只有2个取代基:③1mol该物质最多可消耗3mol NaOH,其中氢原子共有五种不同环境的是(写结构筒式)____________