有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
| 实验步骤 |
解释或实验结论 |
| (1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。 |
试通过计算填空:(1)A的相对分子质量为 。 |
| (2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。 |
(2)A的分子式为_____ ___。 |
| (3)另取A 9.0 g,跟足量NaHCO3粉末反应,生成 2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。 |
(3)用结构简式表示A中含有的官能团_____ _、___ ____。 |
(4)A的核磁共振氢谱如下图: |
(4)A中含有__ ______种氢原子。 |
| (5)综上所述,A的结构简式为______ ____。 |
(15分)某研究小组利用下图装置探究铜与浓硫酸反应的产物。
实验步骤与现象如下:
①检查装置气密性,向A中加入5 mL浓硫酸,打开K,将铜丝伸入浓硫酸中,给A处加热,观察到B中品红溶液褪色,再关闭K。
②实验观察到A中液面下铜丝变黑,产生气泡,液面上方产生大量白雾,一段时间后溶液中有白色固体出现,拉出铜丝,停止加热。回答下列问题:
(1)溶液中白色固体是_______ (填化学式),C中CCl4的作用是______________。
(2)取出铜丝,用蒸馏水洗净后伸入到稀硫酸中,铜丝变亮、溶液变蓝。写出A中可能发生反应的化学方程式:_____________________、_____________________。
(3)分离出C中的上层液体,滴加过量稀盐酸和BaCl2溶液,有白色沉淀产生。①分离的操作名称为:______________:②白色沉淀为:______________; ③产生白色沉淀的原因可能是___________________。
(16分) 在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,通入水蒸气,并加热,就可以完成高温下“Fe与水蒸气的反应实验”。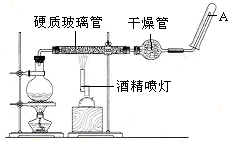
请回答该实验中的问题。
(1)写出该反应的反应方程式:。
(2)实验前必须对整套装置进行气密性检查,操作方法是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)酒精灯和酒精喷灯点燃的顺序是先点燃酒精灯,产生水蒸气后,再点燃酒精喷灯;原因是。
(5)干燥管中盛装是的物质是。
(6)试管中收集气体是H2 ,如果要在A处玻璃管处点燃该气体,则必须对该气体进行,
这一操作的目的是。
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校兴趣小组欲测定硫酸工业尾气中二氧化硫的含量,采用以下方案:
甲方案:如下图所示,图中气体流量计B用于准确测量通过尾气的体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。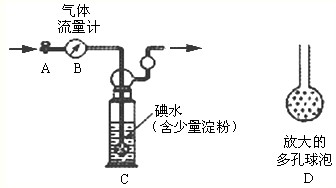
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是。
(2)洗气瓶C中的溶液可以用其他试剂替代,请你举出一种:。
(3)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量 (填“偏高”、“偏低” 或“无影响”)。
乙方案:实验步骤如下面流程图所示:
(4)写出步骤②中反应的化学方程式。
(5)步骤③中洗涤沉淀的方法是。
(6)通过的尾气体积为VL已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为
(用含有V、m的代数式表示)。
丙方案:将乙方案中步骤①省略,直接将尾气通入过量Ba(OH)2溶液中,其余步骤与乙方案相同。
(7)你认为丙方案是否合理,说明理由:。
为了测定足量铜与适量一定浓度的浓硝酸反应生成一氧化氮气体和二氧化氮气体的物质的量之比(用m表示),请从下图中选用合适的实验装置,设计一个合理而简单的实验,用于测定m的值。(不考虑二氧化氮转化为四氧化二氮)其中E装置为量气管,由甲、乙两根玻璃管组成,用橡皮管连通,并装入适量水,甲管有刻度(0~50mL),供量气用,乙管可上下移动,用来调节液面高低。回答下列问题: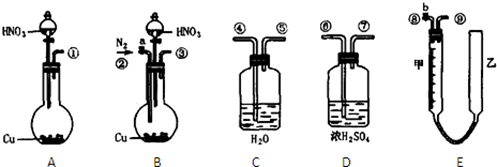
(1)装置的连接顺序是。(填各接口的编号)。
(2)连接好装置并检查气密性后,应打开通入氮气;然后打开____,从乙管注水至充满甲、乙两管,关上a、b。通入氮气的原因是。
(3)实验后,若量气管中气体的体积为VmL(已换算成标准状况下),要测定m的值,还要将___中的溶液做________实验,假设测得其中溶质物质的量为n,用含V和n的式子表示:m=(答案要求化简)。
(4)下列操作中能造成m值偏小的是_。
| A.反应前E中甲管所装水里气泡没赶尽,而最后读数时气泡消失 |
| B.实验后未冷却至室温即开始读数 |
| C.实验前没有先通入足量的氮气 |
| D.实验过程中,E装置乙管的水溢出 |
某学生欲配制6.0 mol/L的H2SO4 1000mL,实验室有三种不同浓度的硫酸:①480 mL 0.5 mol/L的硫酸:②150 mL 25%的硫酸(p=" 1.18" g/mL);③足量的18 mol/L的硫酸。有三种规格的容量瓶:250 mL、500 mL、1000 mL。老师要求把①②两种硫酸全部用完,不足的部分由③来补充。
请回答下列问题:
(1)实验所用25%的硫酸的物质的量浓度为mol/L(保留1位小数)。
(2)配制该硫酸溶液应选用容量瓶的规格为mL。
(3)配制时,该同学的操作顺序如下,请将操作步骤B、D补充完整。
A将①②两溶液全部在烧杯中混合均匀:
B用量筒准确量取所需的18 mol/L的浓硫酸____mL,沿烧杯内壁倒入上述混合液中,并用玻璃棒搅拌,使其混合均匀:
C将混合均匀的硫酸沿玻璃棒注入所选的容量瓶中:
D;
E.振荡,继续向容量瓶中加水,直到液面接近刻度线1 cm~2 cm处;
F.改用胶头滴管加水,使溶液的凹液面恰好与刻度线相切;
G.将容量瓶盖紧,振荡,摇匀。
(4)如果省略操作D,对所配溶液浓度有何影响?(填“偏大”、“偏小”或“无影响”)。
(5)进行操作C前还需注意。