(10分) 铁是人体必须的微量元素,治疗缺铁性贫血的常见方法是服用补铁药物。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:
⑴试剂1是 。
⑵加入KSCN溶液后,在未加新制氯水的情况下,溶液中也产生了红色,其可能的原因是 。
⑶在实验中发现放置一段时间,溶液的颜色会逐渐褪去。为了进一步探究溶液褪色的原因,甲、乙、丙三位同学首先进行了猜想:
| 编号 |
猜 想 |
| 甲 |
溶液中的+3价Fe又被还原为+2价Fe |
| 乙 |
溶液中的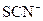 被过量的氯水氧化 被过量的氯水氧化 |
| 丙 |
新制的氯水具有漂白性,将该溶液漂白 |
基于乙同学的猜想,请设计实验方案,验证乙同学的猜想是否正确。写出有关的实验操作、预期现象和结论。(不一定填满,也可以补充)
| 编号 |
实验操作 |
预期现象和结论 |
| |
|
|
⑷另一同学为了检测“速力菲”药片中铁的含量,设计并进行了如下实验:
①取样、碾碎,并称取2.0g,加入过量盐酸,搅拌使其完全溶解;
②向所得溶液中先加入足量H2O2溶液,再加入足量氨水,充分反应后过滤并洗涤沉淀;
③将所得固体灼烧至恒重,得0.8g红棕色固体。
④计算:“速力菲”药片中铁的质量分数为 。
已知用P2O5作催化剂,加热乙醇可制备乙烯,反应温度为80℃~210℃。某研究性小组设计了如下的装置制备并检验产生的乙烯气体(夹持和加热仪器略去)。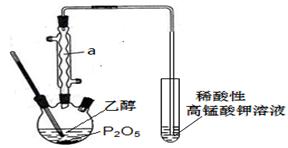

(1)仪器a的名称为_________________
(2)用化学反应方程式表示上述制备乙烯的原理______________________________。
(3)已知P2O5是一种酸性干燥剂,吸水放大量热,在实验过程中P2O5与乙醇能发生作用,因反应用量的不同,会生成不同的磷酸酯,它们均为易溶于水的物质,沸点较低。写出乙醇和磷酸反应生成磷酸二乙酯的化学方程式(磷酸用结构式表示为 )__________________________________________________________。
)__________________________________________________________。
(4)某同学认为用上述装置验证产生了乙烯不够严密,理由是___________________。
(5)某同学查文献得知:40%的乙烯利(分子式为C2H6ClO3P)溶液和NaOH固体混和可快速产生水果催熟用的乙烯,请在上述虚线框内画出用乙烯利溶液和NaOH固体制取乙烯的装置简图(夹持仪器略)。
用含少量铁的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作: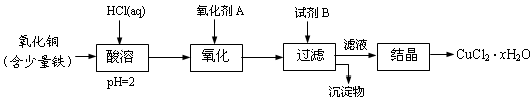
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)氧化剂A可选用_______(填编号,下同)
① Cl2 ② KMnO4 ③ HNO3 ④ H2O2
(2)要得到较纯的产品,试剂B可选用_______
① NaOH ② FeO ③ CuO ④Cu2(OH)2CO3
(3)试剂B的作用是______
① 提高溶液的pH ② 降低溶液的pH ③ 使Fe3+完全沉淀 ④ 使Cu2+完全沉淀
(4)从滤液经过结晶得到氯化铜晶体的方法是_________(按实验先后顺序选填编号)
① 过滤 ② 蒸发浓缩 ③ 蒸发至干 ④ 冷却
(5)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,某兴趣小组设计了两种实验方案:
方案一:称取m g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的质量为n g。
方案二:称取m g晶体、加入足量氢氧化钠溶液、过滤、沉淀洗涤后用小火加热至质量不再减轻为止、冷却、称量所得固体的质量为n g。
试评价上述两种实验方案,其中正确的方案是______,据此计算得x = _________(用含m、n的代数式表示)。
(8分)现有四瓶丢失标签的NaOH、Na2CO3、AlCl3、NH4HSO4溶液,为鉴别四瓶溶液,将四瓶溶液编号为A、B、C、D进行实验。实验过程记录如下: B逐滴加入A中先产生白色沉淀X,继续加入B沉淀消失得无色溶液W;B与C中混合加热得无色气体Y,将Y通入紫色的石蕊试液中,石蕊试液变蓝;C和D以2:1混合得无色无味的气体Z,将Z通入紫色的石蕊试液,石蕊试液变红。根据实验现象请回答:
(1)Y、Z的化学式分别为:Y;Z
X与B反应的离子方程式为。
(2)D溶液pH(填“大于”、“小于”或“等于”)7,原因是(用离子方程式表示):。
(3)等物质的量浓度的A、B、C、D溶液pH由大到小的顺序是。(用化学式表示)
(4)请写出C与过量B反应(加热)的离子方程式。
已知硝酸铜溶液呈蓝色。但在铜与浓硝酸、稀硝酸反应的实验中,同学们发现,除了生成的气体颜色不相同外,最终溶液的颜色也不相同:前者呈绿色,而后者呈蓝色。甲、乙二位同学为此进行了实验探究。
甲:在I、II两支试管中分别加入等体积的浓HNO3和稀HNO3,再向两支试管中分别投入等质量的铜片,充分反应后铜均无剩余。结果:I中溶液呈绿色,II中溶液呈蓝色。
乙:分别取I中的绿色溶液于两支试管Ⅲ、IV中,对试管Ⅲ进行多次振荡、静置,最终溶液颜色由绿色转变为深蓝色;向试管IV中缓缓加水并不停振荡,观察到溶液由绿色变为深蓝色,最后变为淡蓝色。
请回答下列问题:
(1)分别写出Cu与浓HNO3、稀HNO3反应的化学方程式:__________、__________。
(2)甲的实验_______(“能”或“不能”)说明溶液呈现不同的颜色与其物质的量浓度无关,这是因为充分反应后,I、II两试管中Cu(NO3)2溶液的物质的量浓度_______(填“相等”或“不相等”)。
(3)请你根据乙的实验,推测Cu与浓HNO3反应后溶液呈绿色的原因是________
_______________________________________________________________。
(4)请设计一个方案,验证你所得到的上述结论:____________________________
____________________________________________________________________。
某矿抽出的废液中含有大量的K+、Cl—、Br—,还有少量的Ca2+、Mg2+、SO42—。某研究性学习小组所拟取这种废液来制取较纯净的氯化钾晶体及液溴(Br2),他们设计了如下流程:
可供试剂a、b的选择试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2、KMnO4(H+)溶液、稀HNO3。
请根据以上流程,回答相关问题:
(1)试剂a应该选用_______________;
(2)操作①、②、③、④、⑤的名称是_________(填字母)。
| A.萃取、过滤、分液、过滤、蒸发结晶 | B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 | D.萃取、分液、分液、过滤、蒸发结晶 |
(3)除去无色液体I中的Ca2+、Mg2+、SO42-离子,选出C所代表的试剂,按滴加顺序依次是(填化学式)。
(4)调节pH的作用是,操作方法是。
(5)操作⑤中用到的瓷质仪器名称是。