氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,吸附气体的能力强,性质稳定。请回答: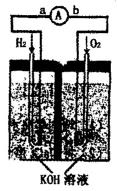
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为 。
(3)电极表面镀铂粉的原因为 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
I.2Li+H2
II.LiH+H2O LiOH+H2↑
①反应I中的还原剂是 。反应Ⅱ中的氧化剂是 。
②已知LiH固体密度为0.82g/cm3。用镁吸收224 L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为 。
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
2012年宾夕法尼亚大学研究人员展示了一种硒化镉纳米晶体,它能被“印”或“涂”在柔软塑料上,制成多种性能优良的电子设备。请回答下列问题:
(1)O、S、Se的电负性最小的是,它们的氢化物中沸点由高到低的顺序是(用化学式表示)。
(2)硒的低价含氧酸盐—亚硒酸钠(Na2SeO3),能促进细胞DNA的增殖活性,延缓细胞衰老,SeO32-中的Se原子杂化方式是,空间构型为;
(3)镉(Cd)与锌为同族相邻元素,在周期表中Cd位于区,Cd 的最外层电子排布图是。
(4)锌单质晶体是六方最密堆积,原子按(填“ABABAB”或“ABCABCABC”)的方式堆积而成,晶体中Zn原子的配位数为,锌易与某些小分子物质形成配合物,在[Zn(NH3)4]2+离子中提供孤电子对的原子是(填元素符号)。
(5)镉和锌都是电的良导体,非金属晶体石墨也具有良好的导电性,下图为石墨晶体结构示意图及提供的资料,12g石墨晶体中正六边形的数目为,石墨的密度为g·cm-3。(阿伏加德罗常数为NA)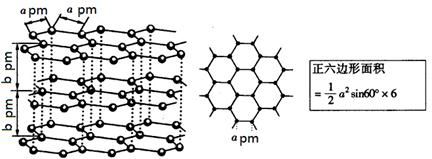
有机物A、B的分子式均为C10H10O5,均能发生如下变化。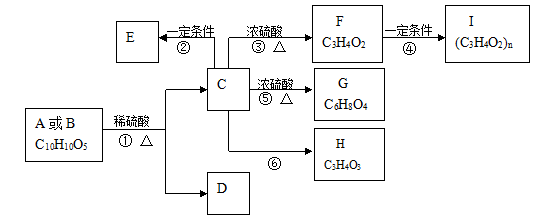
已知:
①A、B、C、D等均能与NaHCO3反应
②只有A、D能与FeCl3溶液发生显色反应,A苯环上的一溴代物只有两种
③F能使溴水褪色,
④H不能发生银镜反应
根据题意回答下列问题:
(1)反应③的反应类型是;有机物F含氧官能团的名称是;
(2)写出有机物的结构简式D、H;
(3)写出反应⑤的化学方程式;
(4)D的同分异构体有很多种,写出同时满足下列要求的所有同分异构体的结构简式;
①能与FeCl3溶液发生显色反应
②能发生银镜反应但不能水解
③苯环上的一卤代物只有2种
煤是重要的能源,也是化工生产的重要原料。
(1)煤燃烧产生的废气直接排放到空气中,可能导致的环境污染问题是_______。
(2)下图是对煤矿燃烧产生的废气进行常温脱硫处理的流程示意图。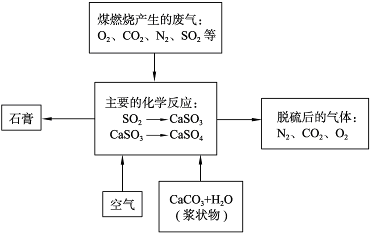
①废气脱硫过程中,主要反应的化学方程式为______________、_____________;
②在煤矿中直接添加一种物质,可有效减少煤矿燃烧产生的SO2,该物质是___;
③石膏的工业生产中的用途是_________________(写出一种用途即可)。
(3)煤经过___________(填加工方法)可以得到焦炉煤气、煤矿焦油和焦炭。煤焦油经过_______(填加工方法)可得到芳得族化合物。煤矿也可以用氢化法转化燃油,氢化法的本质是______________。
(4)煤可以液化转化为CH3OH,有人设计出在KOH溶液中用电极表面镀一层细小的铂粉做电极,铂吸附气体的能力强,性质稳定,利用CH3OH和O2构成的燃料电池的能量转化主要形式是 ,负极反应式为 ,电极表面镀铂粉的原因为 。
物质的结构是决定物质性质的重要因素。请回答下列问题:
(1)基态Ni原子核外电子排布式为____________;第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是_______________。
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分为0.069nm和0.078nm,则熔点NiO____________FeO(填“<”或“>”);NiO晶胞中Ni2+的配位数为____________。
(3)肼可用作火箭燃料,燃烧时发生的反应是:N2O4+2N2H4=3N2+4H2O,若该反应中有4molN—H键断裂,形成的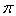 键有________mol。
键有________mol。
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图1所示.该合金化学式为;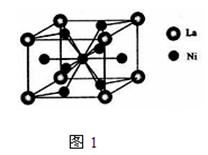
(5)丁二酮肟常用于检验Ni2+:在稀氨水介质中,丁二酮肟Ni2+反应可生成鲜红色沉淀,其结构如图2所示:
①该结构中,碳碳之间共价键是σ键,碳氮之间共价键是,氮镍之间形成化学键是;
②该结构中,氧氢之间除共价键外还可存在;
③该结构中,碳原子杂化轨道有
下图为某药物合成路线的一部分。
(1)A→B的化学方程式为,E中的含氧官能团名称为、。
(2)若②的反应历程经历了中间产物 ,则该反应历程先后经历的反应类型为、。试剂X的结构简式为。
,则该反应历程先后经历的反应类型为、。试剂X的结构简式为。
(3)写出两种满足下列要求的D的同分异构体的结构简式,。
①分子中有4种化学环境不同的氢原子;
②可发生水解反应,一种产物可发生银镜反应,另一种能与FeCl3发生显色反应;
③分子中的氯原子不与苯环直接相连。