用纯净的锌粒与稀盐酸反应制取氢气气体,请回答:
(1)实验过程如下图所示,分析判断________段化学反应速率最快,这段反应速率最快的原因是 。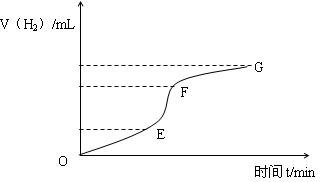
(2)为了减缓上述反应的速率,欲向溶液中加入下列物质,你认为可行的是( )
| A.蒸馏水 | B.氯化钠固体 | C.氯化钠溶液 | D.浓盐酸 |
(3)除了上述方法外,你认为还可以采取哪些措施来减缓化学反应速率?(回答一种即可)
。
甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用天然气为原料,分为两阶段制备甲醇:
(ⅰ)制备合成气:CH4(g)+H2O(g) CO(g)+3H2(g)
CO(g)+3H2(g)
(ⅱ)合成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
请回答下列问题:
(1)制备合成气:将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),在一定条件下发生反应(i);CH4的平衡转化率与温度、压强的关系如图所示。
①已知100℃时达到平衡的时间为5min,则从反应开始到平衡,用氢气表示的平均反应速率为:v(H2)= 。
100℃时该反应的平衡常数K= ;若升高温度,平衡常数K将 (填“增大”、“减小”或“不变”)。
②图中p1 p2(填“<”、”“>”或“=”)。
③为解决合成气中H2过量而CO不足的问题,原料气中需添加CO2,发生反应如下:CO2(g)+H2(g) CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
CO(g)+H2O(g),为了使合成气配比最佳,理论上原料气中甲烷与二氧化碳体积比为 。
(2)合成甲醇:在Cu2O/ZnO作催化剂的条件下,向2L的密闭容器中通入1mol
CO(g)和2mol H2(g),发生反应(ⅱ)。
①反应(ⅱ)需在 (填“高温”或“低温”)才能自发进行。
②据研究,反应过程中起催化作用的为Cu2O,反应体系中含少量的CO2 有利于维持Cu2O的量不变,原因是_________________(用化学方程式表示)。
反应A(g)+B(g) C(g) +D(g)过程中的能量变化如图所示,回答下列问题。
C(g) +D(g)过程中的能量变化如图所示,回答下列问题。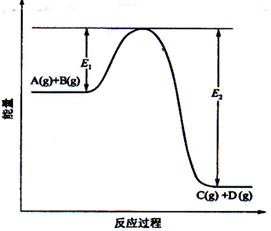
(1)该反应是________________反应(填“吸热”“放热”);
(2)当反应达到平衡时,升高温度,A的转化率 (填“增大”“减小”“不变”),
原因是_______________________;
(3)在反应体系中加入催化剂,反应速率增大,E1_________,E1﹣E2________。(填“增大” , “减小” 或 “不变”)。
选择下列实验方法分离物质,将分离方法的序号填在横线上。A萃取分液 B升华 C结晶 D分液 E蒸馏 F层 析 G过滤
(1)_________分离饱和食盐水与沙子的混合物。
(2)_________从硝酸钾和氯化钠的混合液中获得硝酸钾。
(3)_________分离水和汽油的混合物。
(4)_________分离CCl4(沸点为76.75℃)和甲苯(沸点为110.6℃)的混合物。
下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)以上四组物质中与别不同的物质依次是(填化学式)A ;B ;C ;D 。
(2)这四种物质相互作用可生成一种新物质(碱式碳酸铜,化学式Cu2(OH)2CO3),该反应 氧化还原反应(填“是”或“否”)。
483g Na2SO4·10H2O中所含的Na+的物质的量是 和SO42—的物质的量是 ,所含H2O分子的数目是 个。