下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO
B.H2、C、P、Cu
C.O2、Fe、Cu、Zn
D.HCl、H2O、H2SO4、HNO3
(1)以上四组物质中与别不同的物质依次是(填化学式)A ;B ;C ;D 。
(2)这四种物质相互作用可生成一种新物质(碱式碳酸铜,化学式Cu2(OH)2CO3),该反应 氧化还原反应(填“是”或“否”)。
下图表示某些常见物质之间的转化关系(反应条件已略去),其中A、D为气态非金属单质,B、C为金属单质,B为红色,E、F、G、H为化合物,G为无色液体,甲、乙、丙、丁、戊为溶液,丙为强酸的稀溶液。①、②均为工业冶炼B的反应。
请回答下列问题:
(1)F由同族两种元素组成,可用于食物增白,也是大气污染物之一,污染来源主要是,它在大气中可形成丙,反应的化学方程式为。反应④也可以生成丙,反应的离子方程式为;
(2)由反应①制得的金属B含杂质,工业上用方法将B提纯至99.95%以上。利用热还原制得的金属C,也含杂质,在潮湿的中性环境中,C较易发生腐蚀,化学方程式为,C经反应③的处理,表面生成黑色晶体H后,可减缓蚀;
(3)检验溶液丁中金属离子的方法是;
(4)E可由单质直接化合得到,则E的化学式为,反应①的化学方程式为。
[有机化学基础]
某有机物X(C12H13O6Br)遇到FeCl3溶液显紫色,其部分结构简式如下: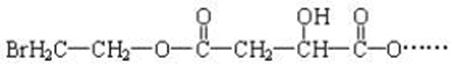
已知:X在足量的氢氧化钠水溶液中加热,可以得到A、B、C三种有机物。(1)C用核磁共振氢谱分析,发现只有一个吸收峰。(2)室温下A经盐酸酸化可以得到苹果酸E,试回答:(1)B中所含官能团的名称是_______。
(2)C的结构简式为________________。
(3)E能发生的反应类型是_______(填序号)。
①加成反应 ②消去反应 ③氧化反应 ④酯化反应
(4)E的一种同分异构体F有如下特点:1molF可与3mol金属钠发生反应放出33.6LH2(标准状况下),1molF也可与足量NaHCO3溶液反应生成1molCO2,1molF 还可与足量的银氨溶液反应生成2molAg。则F的结构简式可能是(请写出两种)________________。
(5)在一定条件下两分子E可以生成六元环酯,写出此反应的化学方程式:
_______________________________ ________。
[物质结构与性质]
I . 固体二氧化碳外形似冰,受热汽化无液体产生,俗称“干冰”,根据干冰晶胞结构回答: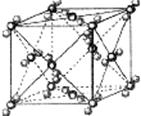
(1)干冰中一个分子周围有__________个紧邻分子。
(2)堆积方式与干冰晶胞类型相同的金属有_________(从“Cu、Mg、K、Po”中选出正确的),其空间利用率为_______。
(3)CO2中心原子的杂化方式为_______,有一种与CO2互为等电子体的离子,能用于鉴别Fe3+,写出其电子式______________________。
II. 钇钡铜氧的晶胞结构如图。研究发现,此高温超导体中的铜元素有两种价态,+2价和+3价。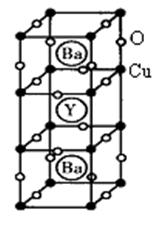
(4)写出Cu3+的电子排布式:。
(5)根据图示晶胞结构,推算晶体中Y,Cu,Ba和O原子个数比,确定其化学式为:。
(6)根据(5)所推出的化合物的组成,(该化合物中各元素的化合价为Y +3、Ba +2),计算该物质中+2价和+3价的Cu离子个数比为:_______________。
[化学与技术]硫酸在日常生产生活中应用非常广泛。请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫黄为原料,以硫黄为原料的优点是。
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3,是一个关键步骤。压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N2 82%);
  压强/Mpa 压强/Mpa转化率/% 温度/℃ |
0.1 |
0.5 |
1 |
10 |
| 400 |
99.2 |
99.6 |
99.7 |
99.9 |
| 500 |
93.5 |
96.9 |
97.8 |
99.3 |
| 600 |
73.7 |
85.8 |
89.5 |
96.4 |
利用表中数据分析。在实际生产中选择的适宜生产条件是:温度_______ ℃,压强 ___________MPa。
(3)选择适宜的催化剂,是否可以提高SO2的转化率? _______(填“是”或“否”),是否可以增大该反应所放出的热量?(填“是” 或“否”)。
(4)为提高SO3吸收率,实际生产中用吸收SO3。
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)。
| A.保护环境。防止空气污染 | B.充分利用热量,降低生产成本 |
| C.升高温度,提高SO2的转化率 | D.防止催化剂中毒 |
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用 ________(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式_______________________________________。
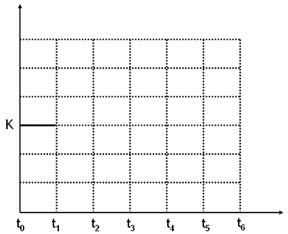
向某密闭容器中加入0.6molA、0.2molC和一定量的B三种气体,一定条件下发生反应,各物质浓度随时间变化如甲图所示(其中t0-t1阶段c(B)未画出)。乙图为反应体系中反应速率随时间变化的情况,且四个阶段都只改变一种条件(催化剂、温度、浓度、压强,每次改变条件均不同),已知t3~t4阶段为使用催化剂。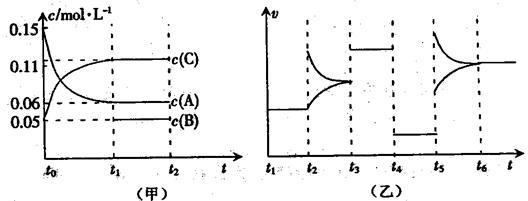
(1)若t1=5s,则t0~t1阶段以C浓度变化表示的反应速率为v(C)=________mol/(L•s)。
(2)若t2~t3阶段,C的体积分数变小,此阶段v(正)___v(逆)(填“>”、“=”或“<”)。
(3)t4~t5阶段改变的条件为_______,B的起始物质的量为_______。
(4)t5~t6阶段容器内A的物质的量共减小0.03mol,而此过程中容器与外界的热交换总量为akJ,写出该反应的热化学方程式:__________________________________。
(5)该反应的化学平衡常数K可表示为_______________。[用含c(A) 、c(B) 、c(C)的式子表示]
并在下图中补画出t1~t6 各阶段K的变化趋势图像