.根据下列要求,从①H2O ②CH2=CH2 ③CH3COOH ④HNO3 ⑤CH3CH2OH中选择恰当的反应物,并写出对应的化学方程式,指出反应类型。
| |
化学方程式 |
反应类型 |
| (1)得到乙醇的反应 |
|
|
| (2)与苯发生取代反应 |
|
|
| (3)炒菜时加入一些料酒和食醋,可使饭菜变得味香、可口的原因 |
|
酯化反应 |
| (4)由乙烯合成高分子化合物 |
|
|
(8分)下列为一些常见物质的相互转化关系图。已知:A是生活生产中常用的一种金属单质,B为淡黄色粉末,C在常温下为无色液体,H为白色沉淀,J为红褐色沉淀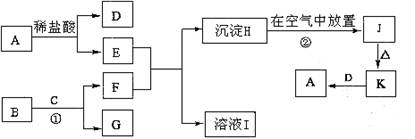
请写出:
(6分,每空2分)
(1)有以下几种试剂:A.NaOH溶液 B.澄清石灰水 C.品红溶液 D.CaCl2溶液
选用合适的试剂鉴别下列两组物质(填字母代号)。
①SO2和CO2 ________②Na2CO3和NaHCO3 ________
(2)玻璃棒是化学实验中常用的仪器,教科书中下列有关实验过程中,不需要使用玻璃棒进行操作的是(填字母代号)__________。
A.配制一定物质的量浓度的溶液 B.浓硫酸的稀释
C.用CCl4萃取碘水中的碘 D.氢氧化铁胶体的制备
E.用充满氨气的烧瓶做喷泉实验
已知: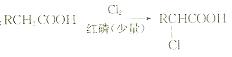
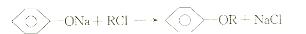
冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下: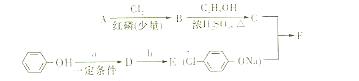
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24L CO2(标准状况),A的分子式为。
(2)写出符合A分子式的所有甲酸酯的结构简式:。
(3)B是氯代羧酸,其核磁其振氢谱有两个峰,写出B→C的反应方程式:。
(4)C+E→F的反应类型为,F的结构简式为:。
(5)D的苯环上的有种氢,b所代表的试剂是。
电浮选凝聚法是工业上采用的一种污水处理方法:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3沉淀。Fe(OH)3有吸附性,可吸附污物而沉积下来,具有净化水的作用。阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用。
某科研小组用电浮选凝聚法处理污水,设计装置如下图所示: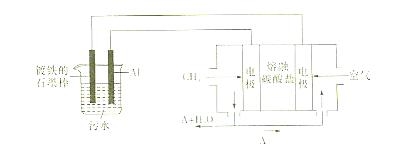
(1)实验时若污水中离子浓度较小,导电能力较差,产生气泡速率缓慢,无法使悬浮物形成浮渣。此时,应向污水中加入适量的。
a.H2SO4b.BaSO4c.Na2SO4 d.NaoH e.CH3CH2OH
(2)电解池阳极的电极反应分别是①;②。
(3)电极反应①和②的生成物反应得到Fe(OH)3沉淀的离子方程式是:。
(4)熔融盐燃料电池是以熔融碳酸盐为电解质,以CH4为燃料,空气为氧化剂,稀土金属材料为电极。已知负极的电极反应式为:CH4+4CO32—8e-5CO2+2H2O。
①正极的电极反应是。
②为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定。为此电池工作时必须有部分A物质参加循环。则A物质的化学式是。
(5)实 验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
验过程中,若在阴极产生了44.8L(标准状况)气体,则熔融盐燃料电池消耗CH4(标准状况)L。
X、Y、Z、W为含有相同电子数的分子或离子,均由原子序数小于10的元素组成,X有5个原子核。通常状况下,W为无色液体。
已知:X+Y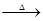 Z+W
Z+W
(1)Z的空间构型为。
(2)液态Z和W的电离相似,都可电离出电子数相同的两种离子,液态Z的电离方程式是。
(3)1mol气态Z与O2反应生成液态W和一种由两种元素组成的气体物质,放出的热量为QkJ,写出该反应的热化学方程式:。
(4)一定温度下,将1mol N2O4置于密闭容器中,保持压强不变,升高温度至T1的过程中,气体由无色逐渐变为红棕色。温度由T1继续升高到T2的过程中,气体逐渐变为无色。若保持T2,增大压强,气体逐渐变为红棕色。气体的物质的量n随温度T变化的关系如图所示。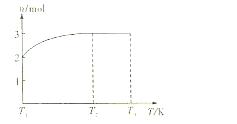
①温度在T1—T2之间,反应的化学方程式是:。
②温度在T2—T3之间,气体的平均相对分子质量是(保留1位小数)。
③若将实验所得的平衡 混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气L。(设空气组成为:N2与O2,体积比4:1)
混和气体通入足量的水中,欲使气体被完全吸收则至少应同时通入标准状况下的空气L。(设空气组成为:N2与O2,体积比4:1)