【化学——选修3:物质结构与性质】A、B、C、D、E是元素周期表中原子序数依次递增的前四周期元素。A原子最外层电子数为内层电子数的3倍;B的焰色反应呈黄色;C的氢化物是一种强酸,其浓溶液可与A、E的化合物反应生成C的单质;D是一种金属元素,其基态原子中有6个未成对电子。请回答下列问题:
(1)D的基态原子价层电子排布式为__________ 。
(2)C的氢化物的沸点比其上一周期同族元素的氢化物低,是因为__________。
(3)A、C电负性大小顺序是_______(用元素符号表示),C的最高价含氧酸根的空间构型为__________,其中心原子的杂化类型为___________。
(4)A、B形成的化合物的晶胞如图所示,该晶胞的化学式为_________,其中A离子的配位数为__________,该晶体类型为___________。
(5)该晶胞的边长为a pm(NA表示阿伏伽德罗常数),则该晶胞的密度为______g/cm3(列出算式)。
根据下图回答问题。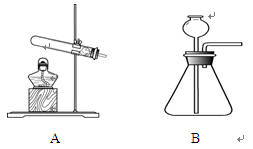
氨是一种重要的化工产品,其化学式为,具有气味,实验室制取氨气的发生装置为(填序号),该反应的化学方程式为。
钠和铝是两种重要的金属。请回答:
⑴两种金属中,金属性强的金属是(填化学式);在冷的浓硫酸或浓硝酸中会发生钝化现象的是(填化学式)。
⑵钠跟水反应的过程如下图所示,写出该反应的化学方程:;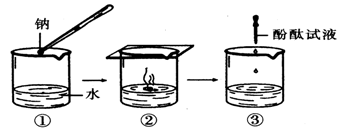
在③中加入酚酞试液后观察到的现象是
向盛有少量FeCl3溶液的试管中滴加KSCN溶液,则溶液变成色,若向盛有少量FeCl2溶液的试管中滴加NaOH溶液,则会看到有色沉淀生成,在空气中该沉淀最终变成色,反应的化学方程式。
现有下列4种物质:① Cl2、② NO、③Na2O2、④Na2SO4溶液。其中,可用向上排空气法收集的气体是(填序号,下同);常温下为无色的气体是;与CO2反应产生的气体能使带火星木条复燃的是;加入BaCl2溶液产生白色沉淀的是。
现有下列4种物质:① NH3、② NO2、③Cl2、④NaHCO3溶液。其中,常温下为黄绿色气体是(填序号,下同),能使湿润的红色石蕊试纸变蓝的气体是,红棕色的气体是,与盐酸反应能生成气体的溶液是。