甲元素的原子序数是9,乙是元素周期表第三周期中金属性最强的元素,丙元素原子核外有三个电子层,最外层电子层上有6个电子,丁元素比丙多一个质子,由此推断:
(1)甲元素在周期表中位于第二周期的_________族
(2)甲元素的气态氢化物的稳定性比HCl的_________(填“强”或“弱”)
(3)乙元素单质在空气中燃烧,生成一种淡黄色的固体的名称是_________ ,指出它所含的化学键的类型_______________________ 。
(4)乙元素原子半径比丙元素原子_________ (填大或小)
(5)丙元素最高价氧化物的水化物的分子式是_________,它的酸性比磷酸的_________( 填“强”或“弱”)
(6)另有A,B,C三种短周期元素,A和B同周期,A和C同主族,三者的原子序数之和为41,三者的最外层电子总数为19,则推断出的元素依次为A________B________C________. (填元素符号)
用双线桥法标出下列反应的电子转移情况和化合价升降情况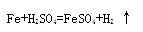
写出下列反应的离子方程式
(1)锌与稀硫酸反应
(2)用石灰石与盐酸反应制取二氧化碳:
酸、碱、盐在水溶液中能导电是因为它们在溶液中发生了,产生能够自由移动的离子。酸是指电离时生成的阳离子全部都是的化合物;碱是指电离时生成的阴离子全部都是的化合物;盐是指电离生成的化合物。
已知2A(g)+B(g)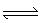 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C )="0.040" mol·L-1,放出热量Q1kJ。
)="0.040" mol·L-1,放出热量Q1kJ。
(1)能说明上述反应已经达到化学平衡状态的是(填写序号);
a.v(C)="2v(B)" b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
(2)若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为(用含Q1、Q2的代数式表示);
(3)500℃时,上述反应的化学平衡常数K=;
(4)已知:K(300℃)>K(350℃),该反应是(填“放”或“吸”)热反应;若反应温度升高,A的转化率(填“增大”、“减小”或“不变”);
(5)某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A)K(B)(填“>”、“<”或“=”)。
A、B、C、D、E是原子序数依次增大的短周期元素,A、D在周期表中的相对位置如下表,且元素A的最高正化合价与最低负化合价的绝对值相差2,B与D属于同主族元素;元素C是一种银白色金属,放置在空气中会迅速被氧化成白色物质。
(1)D的原子结构示意图为 ;
;
(2)元素E在元素周期表中位于第 族;
族;
(3)C、D、E离子半径的大小关系为(用离子符号表示);
(4)元素B的单质与元素C的单质可发生化学反应生成化合物甲,则甲的化学式为
,实验证明甲能够与水发生化学反应,试写出甲与水反应的离子方程式
;
(5)若乙是元素A的最简单气态氢化物,丙是元素C的最高价氧化物对应的水化物。
①pH相同的乙丙的水溶液,分别用蒸馏水稀释到原来的x、y倍,稀释后两种溶液的pH仍然相同,则xy(填写“>”、“<”或“=”=;
②在微电子工业中,乙的水溶液常用作刻蚀剂H2O2的清除剂,所发生反应的产 物不污染环境,其化学方程式为(不需要配平)。
物不污染环境,其化学方程式为(不需要配平)。