(共8分)在原子序数1—18号元素中:(用元素名称填写,写符号不得分)
a与水反应最剧烈的金属是_____________。
b在空气中容易自燃的单质名称是_____________。
c除稀有气体外,原子半径最大的元素是___ _____,它的原子结构示意图是 ___________。
d气态氢化物水溶液呈碱性的元素是_____________。
e气态氢化物最稳定的化学式是_____________。
f最高价氧化物对应水化物的酸性最强的元素是_____________。
g最高价氧化物对应水化物的碱性最强的元素是____ ____
向2 L密闭容器中通入a mol气体A和b mol气体B,在一定条件下发生反应:xA(g)+yB(g) pC(g)+qD(g)已知:平均反应速率v(C)=
pC(g)+qD(g)已知:平均反应速率v(C)=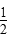 v(A),反应2 min时,A的浓度减少了
v(A),反应2 min时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成,回答下列问题:
mol,有a mol D生成,回答下列问题:
(1)反应2 min内v(A)=________,v(B)=________
(2)化学方程式中,x=__________,y=__________,p=________,q=________
(3)反应平衡时,D为2a mol,则B的转化率为________。
(4)如果只升高反应温度,其他反应条件不变,平衡时D为1.5a mol,则该反应的ΔH________0(填“>”“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1 L,进行同样的实验,则与上述反应比较:
①反应速率________(填“增大”、“减小”或“不变”),理由是________。
②平衡时反应物的转化率________(填“增大”“减小”或“不变”),理由是________。
t ℃时,将3 mol A和1 mol B气体通入体积为2 L的密闭容器中(容积不变),发生反应:3A(g)+B(g) xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
xC(g)。2 min时反应达到平衡状态(温度不变),剩余了0.8 mol B,并测得C的浓度为0.4 mol·L-1,请填写下列空白:
(1)从开始反应至达到平衡状态,生成C的平均反应速率为________。
(2)x=________;平衡常数K=________。
(3)若继续向原平衡混合物的容器中通入少量氦气(假设氦气和A、B、C都不反应)后,化学平衡________(填写字母序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)若向原平衡混合物的容器中再充入a mol C,在t ℃时达到新的平衡,此时B的物质的量为n(B)=________mol。
反应A(g)+B(g) C(g)+D(g)过程中的能量变化如图所示,回答下列问题。
C(g)+D(g)过程中的能量变化如图所示,回答下列问题。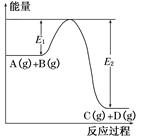
(1)该反应是________(填“吸热”或“放热”)反应。
(2)当反应达到平衡时,升高温度,A的转化率________(填“增大”“减小”或“不变”),原因是________________________________________
(3)反应体系中加入催化剂对反应热是否有影响?________,原因是__________________________________________
(4)在反应体系中加入催化剂,反应速率增大,E1和E2的变化是:E1________,E2________。(填“增大”“减小”或“不变”)
(1)合成氨反应的热化学方程式:N2(g)+3H2(g) 2NH3(g)ΔH=-92.2kJ·mol-1
2NH3(g)ΔH=-92.2kJ·mol-1
已知合成氨反应是一个反应物不能完全转化为生成物的反应,在某一定条件下,N2的转化率仅为10%,要想通过该反应得到92.2 kJ的热量,至少在反应混合物中要投放N2的物质的量为________ mol。
(2)肼(N2H4)-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼-空气燃料电池放电时:
正极的电极反应式:__________________________,
负极的电极反应式:__________________________。
(3)如图是一个电解过程示意图。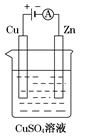
①锌片上发生的电极反应式是:_______________________
②假设使用肼-空气燃料电池作为该过程中的电源,铜片质量变化为128 g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积分数为20%)。
请按要求回答下列问题。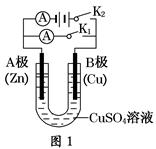
(1)根据图1回答①②:
①若断开K2,闭合K1。
A电极可观察到的现象________________________________________________;
B极的电极反应式为__________________________________________________。
②若断开K1,闭合K2,A电极可观察到的现象是________________;B极的电极反应式为____________。
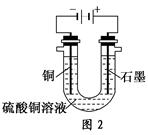
(2)根据图2回答③④:
③将较纯净的CuSO4溶液放入如图所示的装置中进行电解,石墨电极上的电极反应式为________________,电解反应的离子方程式为________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。