下列晶体熔化时,化学键没有被破坏的是
| A.氯化铵 | B.金刚石 | C.冰醋酸 | D.硫酸钠 |
下列化学用语表示正确的是
| A.氯化钙的化学式 CaCl |
B.HCl分子的电子式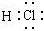 |
C.氯化钠的电子式 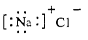 |
D.氯原子的结构示意图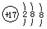 |
下列物质中属于同分异构体的一组是
| A.O2和O3 | B.CH4和C2H6 |
| C.CH3OCH3和CH3CH2OH | D.1H和2 H |
下列做法不利于金属防护的是
| A.菜刀切菜后不洗净就放回刀架 | B.将钢铁制成不锈钢 |
| C.在铁塔的表面喷油漆 | D.埋在地下的钢管与锌块连接 |
可逆反应在一定条件下达到化学反应限度时
| A.反应停止了 | B.正反应速率与逆反应速率均为零 |
| C.反应物和生成物浓度相等 | D.正反应速率和逆反应速率相等 |
下列措施不能增大反应速率的是
| A.增大压强 | B.降低温度 |
| C.提高反应物浓度 | D.使用合适的催化剂 |