请根据题目要求回答下列问题:
(1)工业接触法制硫酸的生产中用到的设备有:①沸腾炉② ,
③吸收塔,写出设备②中,发生的主要反应的化学方程式 。
(2)已知SO2转化为SO3的反应为放热反应,下图中正确的是 (填序号)。
(3)在吸收塔中,为了提高SO3的吸收率,工业上选择的吸收剂是 (填序号)。
| A.H2O | B.稀H2SO4 |
| C.98.3%H2SO4 | D.NH3·H2O溶液 |
(4)在101Kpa时,燃烧1kg含FeS2质量分数为60%的黄铁矿,放出4265kJ的热量(假设杂质不参加反应),则表示FeS2燃烧热的热化学方程式为 。
多原子分子氰(CN)2、硫氰(SCN)2和(OCN)2的性质与卤素单质相似,故称它们为拟卤素。它们可以生成酸和盐(见下表,表中X代表F、Cl、Br或I)。
| 卤素 |
氰 |
硫氰 |
① |
|
| “单质” |
X2 |
(CN)2 |
(SCN)2 |
(OCN)2 |
| 酸 |
HX |
HCN |
② |
HOCN |
| 盐 |
KX |
KCN |
KSCN |
③ |
(1)在表中①②③空格处应分别填写_______、、_______。
(2)完成下列反应的化学方程式或离子方程式。
①(CN)2和KOH溶液反应的化学方程式为:。
②已知阴离子的还原性强弱为:Cl-<Br-<CN—<SCN-<I-。试写出在NaBr和KSCN的混合溶液中加入(CN)2反应的离子方程式:____________________________________。
写出下列过程的离子方程式。
⑴除去铁粉中混有的铝粉
⑵除去CO2中混有的HCl
⑶NaAlO2溶液中通入少量CO2
⑷1 mol/L 100 mL FeBr2溶液中通入2.24 L Cl2(标准状况)
为验证卤素单质氧化性的相对强弱,某小组用右图所示装置进行试验(夹持仪器已略去,气密性已检验)。试验过程: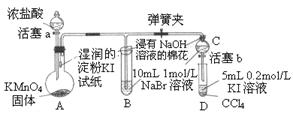
I.打开弹簧夹,打开活塞a,滴加浓盐酸。
II.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
III.当B中溶液由黄色变为棕色时,关闭活塞a。
IV.……
试回答下列问题:
(1)A中产生 色气体,其结构式是 。
(2)能使湿润的淀粉—KI试纸变蓝的气体是 。
(a) Cl2 (b) N2O4 (c) I2蒸气 (d) SO2 (e) O3 (f) CO2
(3)滴加浓盐酸前,分液漏斗首先要 。
(4)过程III实验目的是 。
(5)A中产生氯气的离子方程式为 。
(6)B中浸有NaOH溶液的棉花作用是 ,写出反应的离子方程式 。
美国科学家最近研究发现阿司匹林可降低患哮喘的风险。这项研究成果发表在《美国呼吸系统疾病护理医学杂志》上。阿司匹林(乙酰水杨酸)的合成原理是: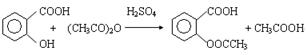
试回答下列问题:
(1)该反应的类型是 。
(2)反应中的4种有机物,遇FeCl3溶液显紫色的是(填名称) 。
(3)1 mol阿司匹林最多可与 mol NaOH溶液反应。
(4)同时符合下列3个条件的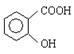 的同分异构体有 种。
的同分异构体有 种。
①遇FeCl3溶液显紫色 ②苯环上含有两个取代基
双氧水(H2O2)是一种极弱电解质,也是一种“绿色氧化剂”。为了贮存、运输的方便,工业上将其转化为固态过碳酸钠(2Na2CO4·3H2O),该物质具有Na2CO3与H2O2的双重性质。请回答下列问题:
(1)写出H2O2的电子式: ,并写出它与SO2反应的化学方程式 。
(2)若把H2O2看成二元弱酸,写出它在水中第一步电离的方程式 。
(3)下列物质不会使过碳酸钠失效的是
| A.MnO2 | B.NaHCO3 | C.H2S | D.CH3COOH |
(4)稀H2SO4不与Cu反应,但在稀H2SO4中加入H2O2后则可使Cu溶解,写出该反应的化学方程式,并用单线桥标明电子转移的方向和数目。
(5)H2O2成为“绿色氧化剂”的理由是 。