X、Y、Z三种短周期元素,它们的原子序数之和为16 。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是
。
某实验小组用下列装置进行乙醇催化氧化的实验。
(1)实验过程中铜网出现黑色和红色交替的现象,请写出相应的化学反应方程式_______________、________________________。在不断鼓入空气的情况下,熄灭酒精灯,反应仍能继续进行,说明该乙醇氧化反应是__________反应(吸热或放热)。
(2)甲和乙两个水浴作用不相同。甲的作用是___________;乙的作用是______________。
(3)反应进行一段时间后,干燥试管a中能收集到不同的物质,它们是_________________。集气瓶中收集到的气体的主要成分是__________________。
(4)若试管a中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有______________。要除去该物质,可先在混合液中加入________(填字母序号)。
a.氯化钠溶液b.苯 c.碳酸氢钠溶液 d.四氯化碳
然后,再通过__________(填实验操作名称)即可除去。
三氯化六氨合钴(Ⅲ)是一种重要的配合物原料,实验室制备三氯化六氨合钴(Ⅲ)的化学方程式为:2CoCl2·6H2O+NH4Cl+10NH3+H2O2 2[Co(NH3)6]Cl3+14H2O,实验流程如下:
2[Co(NH3)6]Cl3+14H2O,实验流程如下: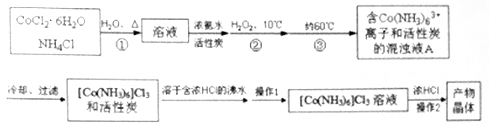
已知:[Co(NH3)6]Cl3在水中电离为[Co(NH3 )6]3+和Cl-,[Co(NH3)6]Cl3的溶解度如下表:
| 温度(℃) |
0 |
20 |
47 |
| 溶解度(g) |
4.26 |
6.96 |
12.74 |
请回答下列问题:
(1)第①步需在煮沸NH4Cl溶液中加入研细的CoCl2·6H2O晶体,加热煮沸与研细的目的是。
(2)H2O2的作用是,第③步中保持60℃的加热方法是。
(3)过滤时滤纸先用蒸馏水润湿,然后用压实滤纸,排出滤纸与漏斗之间的气泡。
(4)实验操作1为,[Co(NH3)6]Cl3溶液中加入浓HCl的目的是。
(5)现称取0.2675g[Co(NH3)6]Cl3(相对分子质量为267.5),在A中发生如下反应:
[Co(NH3)6]Cl3+3NaOH Co(OH)3↓+6NH3↑+3NaCl(装置见下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水,加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2—3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。已知:
Co(OH)3↓+6NH3↑+3NaCl(装置见下图),C中装0.5000mol·L-1的盐酸25.00mL,D中装有冰水,加热烧瓶,使NH3完全逸出后,用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,加入2—3滴甲基红指示剂,用0.5000mol·L-1的NaOH滴定。已知: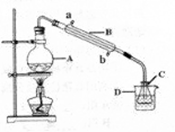
| 指示剂 |
颜色 |
变色的PH范围 |
||
| 甲基红 |
红 |
橙 |
黄 |
4.4—6.2 |
①仪器A的名称是。
②当滴定到终点时,共需消耗NaOH溶液mL。(准确到0.01mL)
③若用上述原理测定某[Co(NH3)x]Cl3晶体中x值,实验过程中未用少量蒸馏水冲洗导管下端内外壁上粘附的酸液于C中,则x值将(填“偏大”、“偏小”或“不变”
某化学兴趣小组拟用下图装置制备氢氧化亚铁并观察其颜色。提供化学药品:铁粉、稀硫酸、氢氧化钠溶液。
(1)稀硫酸应放在中(填写仪器编号)。
(2)本实验通过控制A、B、C三个开关,将仪器中的空气排尽后,再关闭开关、打开开关就可观察到氢氧化亚铁的颜色。试分析实验开始时排尽装置中空气的理由。
(3)实验时为防止仪器2中铁粉通过导管进入仪器3中,可采取的措施是。
(4)在FeSO4溶液中加入(NH4)2SO4固体可制备硫酸亚铁铵晶体[(NH4)2SO4·FeSO4·6H2O](式量为392),该晶体比一般亚铁盐稳定,不易被氧化,易溶于水,不溶于乙醇。
①为洗涤(NH4)2SO4·FeSO4·6H2O粗产品,下列方法中最合适的是。
A.用冷水洗B.先用冷水洗,后用无水乙醇洗
C.用30%的乙醇溶液洗 D.用90%的乙醇溶液洗
②为了测定产品的纯度,称取a g产品溶于水,配制成500mL溶液,用浓度为c mol·L-1的酸性KMnO4溶液滴定。每次所取待测液体积均为25.00mL,实验结果记录如下:
| 实验次数 |
第一次 |
第二次 |
第三次 |
| 消耗高锰酸钾溶液体积/mL |
25.52 |
25.02 |
24.98 |
则该产品纯度为。上表中第一次实验中记录数据明显大于后两次,其原因可能是。
A.实验结束时俯视刻度线读取滴定终点时酸性高锰酸钾溶液的体积
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡
C.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗
D.该酸性高锰酸钾标准液保存时间过长,有部分变质,浓度降低
某化学学习小组发现在碱性溶液中,NO2会发生如下反应: 2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
2NO2 + Na2CO3 = NaNO2 + NaNO3 + CO2
于是提出猜想,NO2和碱性的NaHCO3溶液也能发生类似反应。该小组利用如图所示装置,使NO2和NaHCO3溶液充分反应并获得反应液X。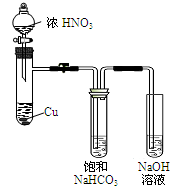
(1)①NaHCO3溶液呈碱性的原因是。
②Cu与浓硝酸反应的现象是。
③欲从反应后的溶液中得到硝酸铜晶体,操作步骤是:蒸发浓缩、、过滤。
(2)该小组同学为了对猜想进行探究,进行如下讨论和实验。
④甲同学认为,可通过检验X中是否存在NO3-的方法验证猜想。但经讨论后认为不可行,你认为其原因是。
⑤乙同学在X中加入少量K2Cr2O7溶液,结果溶液褪色,则产物中含有NaNO2。根据以上信息,写出NO2与NaHCO3溶液反应的离子方程式。
⑥已知在酸性条件下NO2-能将I-氧化为I2。你认为能否用KI淀粉溶液检验X中是否存在NaNO2:_______(填“能”或“不能”),原因是。
⑦已知5NO2-+ 2MnO4-+6H+= 5NO3-+ 2Mn2+ +3H2O。称取a gKMnO4固体,加蒸馏水和少量稀硫酸溶解,配成250mL溶液。移取20.00mL X于锥形瓶,用所配的酸性KMnO4溶液进行滴定,消耗b mL KMnO4溶液。滴点终点的现象是,则X中NaNO2的浓度是(用含a、b的式子表示)。
铁及其化合物在日常生活中很常见
(1)氧化铁是重要工业颜料,用废铁屑制备它的流程如下: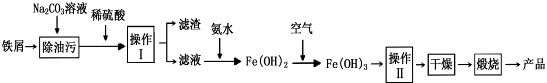
回答下列问题:
①操作II所包含的两项主要基本操作是。上述流程中,Fe(OH)2转化成Fe(OH)3时的化学方程式为。
②将FeCl2溶液高温水解、氧化也可直接制得氧化铁,请写出反应的化学方程式:。
(2)有些同学认为用KMnO4溶液能进行绿矾(FeSO4·7H2O)产品中铁元素含量的测定,反应的离子方程式为:,该滴定过程中(填“是”或“否”)还需要指示剂。
实验步骤如下:
a.考虑绿矾产品可能因为保存不当被空气中氧气所氧化,所以事先取少量绿矾产品溶于水,滴加溶液进行验证。
b.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;
c.量取25.00mL待测溶液于锥形瓶中;
d.用硫酸酸化的0.01000 mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。
请完成下列问题:
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250 mL,配制时需要的仪器除天平、玻璃棒、烧杯、胶头滴管外,还需。
②某同学设计的下列滴定方式,最合理的是________(夹持部分略去)(填字母序号)。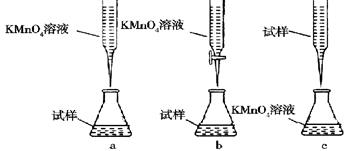
③计算上述样品中FeSO4·7H2O的质量分数为。