四种元素X、Y、Z、W位于元素周期表的前四周期,已知它们的核电荷数依次增加,且核电荷数之和为51;Y原子的L层p轨道中有2个电子;Z与Y原子的价层电子数相同;W原子的L层电子数与最外层电子数之比为4︰1,其d轨道中的电子数与最外层电子数之比为5︰1。
(1)Y、Z可分别与X形成只含一个中心原子的共价化合物a、b,它们的分子式分别是 、 ;杂化轨道分别是 、 ;a分子的立体结构是 。
(2)Y的最高价氧化物和Z的最高价氧化物的晶体类型分别是 晶体、 晶体。
(3)X的氧化物与Y的氧化物中,分子极性较小的是(填分子式) 。
(4)Y与Z比较,电负性较大的 ,其中W+2价离子的核外电子排布式是 。
废旧硬质合金刀具中含碳化钨(
)、金属钴(
)及少量杂质铁,利用电解法可回收
和
。工艺流程简图如下:
(1)电解时废旧刀具做阳极,不锈钢做阴极,
溶液为电解液。阴极主要的电极反应式为。
(2)净化步骤所得滤饼的主要成分是。回收的洗涤液代替水配制电解液,目的是回收利用其中的。
(3)溶液I的主要成分是。洗涤
不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是。
(4)将
还原成
粉的化学反应方程式为。
化学反应原理在科研和生产中有广泛应用
(1)利用"化学蒸气转移法"制备TaS2晶体,发生如下反应
(Ⅰ)反应(Ⅰ)的平衡常数表达式
=,若
=1,向某恒容密闭容器中加入1
和足量
,
的平衡转化率为,
(2)如图所示,反应(Ⅰ)在石英真空管中进行,先在温度为
的一端放入未提纯的
粉末和少量
,一段时间后,在温度为
的一端得到了纯净的
晶体,则温度
(填"﹥""﹤"或"=")。上述反应体系中循环使用的物质是。
(3)利用
的氧化性可测定钢铁中硫的含量。做法是将钢样中的硫转化为
,然后用一定浓度的
溶液进行滴定,所用指示剂为,滴定反应的离子方程式为,
(4)25℃时,
的电离常数
,则该温度下
的水解平衡常数
=
,若向
溶液中加入少量的
,则溶液中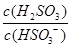 将(填"增大""减小"或"不变")。
将(填"增大""减小"或"不变")。
金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是,
a.
b.
c.
d.
(2)辉铜矿(
)可发生反应
,该反应的还原剂是,当1
发生反应时,还原剂所失电子的物质的量为
。向
溶液中加入镁条时有气体生成,该气体是。
(3)下图为电解精炼银的示意图,(填"
"或"
")极为含有杂质的粗银,若
极有少量红棕色气体产生,则生成该气体的电极反应式为,
(4)为处理银器表面的黑斑(
),将银器置于铝制容器里的食盐水中并与铝接触,
转化为
,食盐水的作用为。
银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:
(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)
(1)电解精炼银时,阴极反应式为;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为。
(2)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式为。
(3)完成煅烧过程中一个反应的化学方程式:CuO+Al2O3 CuAlO2 +↑。
CuAlO2 +↑。
(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为mol CuAlO2,至少需要1.0mol•L—1的Al2(SO4)3溶液L。
(5)CuSO4溶液也可用于制备胆矾,其基本操作是、过滤、洗涤和干燥。
大气中的部分碘源于O3对海水中I-的氧化。将O3持续通入NaI溶液中进行模拟研究。
(1)O3将I-氧化成I2的过程由3步反应组成:
①I-(aq)+ O3(g)=IO-(aq)+O2(g) △H1
②IO-(aq)+H+(aq) HOI(aq) △H2
HOI(aq) △H2
③HOI(aq)+ I-(aq)+ H+(aq) I2(aq)+H2O(l) △H3
I2(aq)+H2O(l) △H3
总反应的化学方程式为______,其反应△H=______。
(2)在溶液中存在化学平衡:I2(aq)+I-(aq) I3-(aq),其平衡常数表达式为_______。
I3-(aq),其平衡常数表达式为_______。
(3)为探究Fe2+对氧化I-反应的影响(反应体系如图),某研究小组测定两组实验中I3-浓度和体系pH,结果见图和下表。
| 编号 |
反应物 |
反应前pH |
反应后pH |
| 第1组 |
O3+ I- |
5.2 |
11.0 |
| 第2组 |
O3+ I-+ Fe2+ |
5.2 |
4.1 |
①第1组实验中,导致反应后pH升高的原因是_______。
②图13中的A为。由Fe3+生成A的过程能显著提高I-的转化率,原因是_______。
③第2组实验进行18s后,I3-下降。导致下降的直接原因有(双选)______。
A.c(H+)减小 B.c(I-)减小 C.I2(g)不断生成 D.c(Fe3+)增加
(4)据图14,计算3~18s内第2组实验中生成I3-的平均反应速率(写出计算过程,结果保留两位有效数字)。