(1)过渡金属元素铁能形成多种配合物,如:[Fe(H2NCONH2)6] (NO3)3[三硝酸六尿素合铁(Ⅲ)]和Fe(CO)x等。
① 基态Fe3+的M层电子排布式为 。
② 尿素(H2NCONH2)分子中C、N原子的杂化方式分别是 、 ;
③ 配合物Fe(CO)x的中心原子价电子数与配体提供电子数之和为18,则x= 。 Fe(CO)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)x晶体属于 (填晶体类型)
(2)O和Na形成的一种只含有离子键的离子化合物的晶胞结构如右图,距一个阴离子周围最近的所有阳离子为顶点构成的几何体为 。已知该晶胞的密度为ρ g/cm3,阿伏加德罗常数为NA,求晶胞边长a= cm。 (用含ρ、NA的计算式表示)
(3)下列说法正确的是 _。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔沸点越高
(4)图1是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良导体。
① 图中d单质的晶体堆积方式类型是 。
② 单质a、b、f 对应的元素以原子个数比1:1:1形成的分子中含 个σ键, 个π键。
③ 图2是上述六种元素中的一种元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因: 。
Ⅰ.氮是地球上含量丰富的一种元 素,氮及其化合物在工农业生产、生活中有着重要作用。请回答:
素,氮及其化合物在工农业生产、生活中有着重要作用。请回答: (1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)2NH3(g)
(1)在一定体积的恒容密闭容器中,进行如下化学反应: N2(g)+3H2(g)2NH3(g)
其化学平衡常数K与温度t的关系如下表:
| t/K |
298 |
398 |
498 |
… |
| K/(mol·L-1)2 |
4.1×106 |
K1 |
K2 |
… |
完成 下列问题:
下列问题:
①比较K1、K2的大小:K1K2(填“>”、“=”或“<”)。
②判断该反应达到化学平衡状态的依据是(填序号)。
A.2v(H2)(正)=3v(NH3)(逆) B.v(N2)(正)=3v(H2)(逆)
C.容器内压强保持不变 D.混合气体的密度保持不变
(2)盐酸肼(N2H6Cl2)是一种重要的化工原料,属于离子化合物,易溶于水,溶液呈酸性,水解原理与NH4Cl类似。
①写出盐酸肼第一步水解反应的离子方程式。
②盐酸肼水溶液中离子浓 度的排列顺序正确的是(填序号)。
度的排列顺序正确的是(填序号)。
A.c(Cl-)>c(N2H62+)>c(H+)>c(OH-)
B.c(Cl-)>c([N2H5·H2O+])> c(H+)>c(OH-)
C.c(N2H62+)+ c([N2H5·H2O+])+c(H+)= c(Cl-)+c(OH-)
D.c(N2H62+)> c(Cl-)>c(H+)>c(OH-)
Ⅱ.水体中重金属铅的污染问题备受关注。查资料得知Pb4+具有很强的氧化性。水中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2(在水中溶解度小)、Pb(OH)3-、Pb(OH)42-,各形态的物质的量的分数α随溶液pH变化的关系如下图所示:
 |
(1)Pb(NO3)2溶液中,c(Pb2+)/c(NO3-)1/2(填“>”、“=”、“<”)。
(2)向Pb(NO3)2溶液滴加盐酸,溶液中c(Pb2+)/c(NO3-)没有变大,反而变小并有沉淀生成,则生成的沉淀可能为。
(3)向Pb(NO3)2溶液中滴加NaOH溶液,溶液也变浑浊,在pH约为时生成沉淀最多,继续滴加NaOH溶液,混合体系又逐渐变澄清。pH = 13时,混合体系中发生的主要反应的离子方程式为: 。
。
材料科学是近年来与化学有关的科学研究热点。某新型无机非金属材料K由两种非金属元素组成。它是一种超硬物质,具有耐磨、耐腐蚀、抗冷热冲击、抗氧化的特征。它是以中学化学中常见物质为原料来生产的。下图虚线框内的其它转化是为探究C的组成而设。G、F、H均为难溶于水的白色固体;图中C、H、K均为含A元素。其余物质均为中学化学中常见物质。
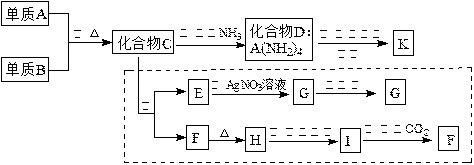 |
请回答下列问题:
(1)指出K可能所属的晶体类型,K中含有的化学键类型为。
(2)写出化学式:化合物C;化合物F。
(3)写出反应③的化学方程式:。
(4)写出反应⑤的离子方程式:。
(5)化合物K与化合物C类似,也能在一定条件下与水反应生成两种化合物,请写出K与水反应的化学方程式:。
(每空3分,共21分)如图所示,甲、乙两池电极材料都是铁棒与碳棒,请回答下列问题:
(1)若两池中均为CuSO4溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒,乙池中的______棒。
②乙池中阳极的电极反应式是____________________。
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的离子方程式是___________________。
②甲池中碳极的电极反应式是______________。
③将湿润的淀粉—KI试纸放在乙池碳极附近,发现试纸变蓝,过一段时间后又发现蓝色退去。这是因为过量的Cl2又将生成的I2氧化。若反应的Cl2和I2物质的量之比为5∶1,且生成两种酸,该反应的化学方程式是_______________________________。
④若乙池转移0.02mol e-后停止实验,池中溶液体积是200mL,则反应后溶液的pH=。
(每空3分,共12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)
根据题意完成下列各题: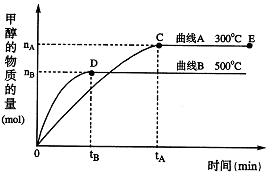
(1)在500℃,从反应开始到刚好达到平衡,氢气的平均反应速率ν(H2)=(用图中相应字母表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的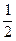 ,下列有关该体系的说法正确的是(填序号)
,下列有关该体系的说法正确的是(填序号)
a氢气的浓度减少b正反应速率加快,逆反应速率变慢,平衡正向移动
c甲醇的物质的量增加 d重新平衡时c(CO)/c(CH3OH)增大
(3)从反应的方向判断,正向进行的反应(填序号:
| A.高温时 | B.低温时 | C.任何温度都能 | D.任何温度都不能)自发进行。 |
(4)在不改变反应物用量的情况下,提高CO的转化率采取的措施是
(答两点即可)
(每空3分,共15分)原子序数依次增大 的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两
的四种常见元素W、X、Y、Z,均可形成一种或多种氧化物。其中W、Y的氧化物是导致酸雨的主要物质,X的氧化物既可以和强酸、亦可以和强碱反应,Z则具有砖红色和黑色的两 种氧化物。
种氧化物。 (1)W元素在元素周期表的位置为
(1)W元素在元素周期表的位置为 ,用电子式表示其气态氢
,用电子式表示其气态氢 化物。
化物。 (2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
(2)含有X的某种物质常用作净水剂,用离子方程式表示其净水的原理是
。 (3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是
(3)Y的一种氧化物,属于酸性氧化物,它既具有氧化性,也具有还原性,还具有漂白性。设计实验,验证该氧化物具有还原性,其操作方法是 。
。
(4)一定物质的量的稀硝酸恰能将Z的砖红色的氧化物氧化,自身被还原成NO。则反应中氧化剂与还原剂的物质的量的比为。