生物质能是一种洁净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有Cu、Zn、Al等元素。写出基态Al原子的价电子排布图 。
(2)根据等电子原理,写出CO分子结构式 。
(3)甲醇催化氧化可得到甲醛,甲醛与新制Cu(OH)2的碱性溶液反应生成Cu2O沉淀。
①甲醇的沸点比甲醛的高,其主要原因是 ;甲醛分子中碳原子轨道的杂化类型为 。
②甲醛分子的空间构型是 ;1mol甲醛分子中σ键的数目为 。
③在1个Cu2O晶胞中(结构如图所示),所包含的Cu原子数目为 。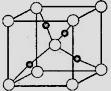
(1)Na2CO3俗称纯碱,因CO32-水解而使其水溶液呈碱性,其实质促进了水的电离,水的Kw (“增大”或“减小”或“不变”),试写出CO32-水解的离子方程式 。加水稀释后,pH(“增大”或“减小”或“不变”,下同),c(HCO3-)/c(CO32-) 。
(2)25℃时,某HCl溶液中c(H+)=1×10-4 mol/L,则该溶液中c (OH-)= ,
(3)某温度(t℃)时,测得0.01mol·L-1 ,100ml的NaOH溶液的pH=11,
①则该温度下水的Kw= 。
②加水稀释后pH=10, 则应加入ml的水。(忽略混合后体积的变化,下同)。
③该温度下将pH=2的硫酸和pH=13的氢氧化钠溶液混合后溶液呈中性,则硫酸和氢氧化钠溶液的体积比=_________
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。
CH3OH(g)+H2O(g),如图表示该反应进行过程中能量(单位为kJ·mol-1)的变化。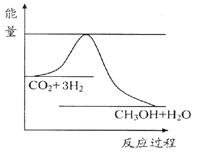
(1)关于该反应的下列说法中,正确的是。(填字母)
A.△H>0,△S>0 B.△H>0,△S<0 C.△H<0,△S<0 D.△H<0,△S>0且在(填“较高”或“较低”)温度下有利于该反应自发进行。
(2)该反应平衡常数K的表达式为。
(3)下列情况不能说明该反应一定达到平衡的是
A.混合气体的平均平均相对分子质量不变 B.混合气体的压强不变
C.单位时间内生成3mol H—H键,同时生成2 mol H—O键
D.混合气体中c (CO2) : c (H2) =" 1" : 3
(4)温度降低,平衡常数K(填“增大”、“不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1L的恒容密闭容器中,充入1molCO2和3molH2,测得CO2和CH3OH(g)的浓度随时间变化如下图所示。从反应开始到平衡,用H2浓度变化表示的平均反应速率v(H2)为mol·L-1·min-1, CO2和H2的转化率比是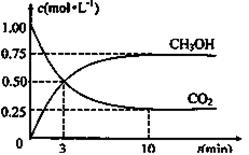
(6)下列措施中能使(5)题中n(CH3OH)/n(CO2)增大的有。(填字母)
A.升高温度 B.加入催化剂 C.将H2O(g)从体系中分离
D.充入He(g),使体系总压强增大 E.再充入1molCO2和3molH2
(7)若在另一个密闭容器中充入1 mol CO2和3 mol H2,保持压强不变,并使初始体积与题中容器体积相等,且在相同的温度下进行反应,达到平衡时该容器中的CO2的体积百分数 ________(5)题中的CO2的体积百分数。(“>”或“<”或“=”,下同)
(8)若为两个容积相同的密闭绝热容器,现向甲容器中充入1 mol CO2(g)和3 molH2(g),乙容器中充入1mol CH3OH(g)和1 mol H2O(g),在相同的温度下进行反应,达到平衡时,甲容器内n(CH3OH) 乙容器内n(CH3OH)。
某同学取等体积、等浓度的a. 稀硫酸b. 盐酸c. 醋酸 三种酸溶液分别加入足量的铝粉进行反应,开始时三种溶液中反应速率快慢顺序是;(填字母,下同),反应完毕产生气体体积的大小顺序是(相同条件)。
(1)已知2 mol氢气燃烧生成液态水时放出572kJ热量,
① 该反应的生成物能量总和 (填“大于”、“小于”或“等于”)反应物能量总和。
② 若2mol氢气完全燃烧生成水蒸气,则放出的热量 (填“>”、“<”或“=”)572 kJ。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101 kPa时:
2SO2(g) +O2(g) 2SO3(g)△H1= -197 kJ/mol;①
2SO3(g)△H1= -197 kJ/mol;①
H2O (g) = H2O(1)△H2= -44 kJ/mol;②
2SO2(g)+O2(g)+2H2O(g) = 2H2SO4(l)△H3= -545 kJ/mol。③
则SO3 (g)与H2O(l)反应的热化学方程式是
[化学--修5:有机化学基础](15分)分别由C、H、O三种元素组成的有机物A、B、C互为同分异构体,它们分子中C、H、O元素的质量比为15︰2︰8,其中化合物A的质谱图如下。
A是直链结构,其核磁共振氢谱有三组峰,且峰面积之比为1︰1︰2,它能够发生银镜反应。B为五元环酯。C的红外光谱表明其分子中存在甲基。其它物质的转化关系如下:
已知:500℃时CH3-CH=CH2 + Cl2 → ClCH2-CH=CH2 + HCl
(1)A的分子式是:___________。A分子中的官能团名称是:___________。
(2)B和G的结构简式分别是:________、_________。
(3)写出下列反应方程式(有机物用结构简式表示)
A与银氨溶液反应:_____________;
G→H:___________________________;
(4)与I具有相同的官能团的同分异构体还有____________种,任写一种:。