某反应过程中体系的能量变化如图所示,
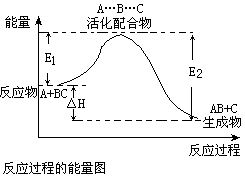 ,下列说法错误的是 ( )
,下列说法错误的是 ( )
| A.反应过程可表示为 A+BC—→[A…B…C] —→AB+C (反应物)(过渡态)(产物) |
| B.E1为反应物的平均能量与过渡态的能量差,称为正反应的活化能 |
| C.此图中正反应的热效应为△H=E1—E2,且E2>E1,所以正反应为放热反应 |
| D.此图中逆反应的热效应△H=E1—E2,为吸热反应 |
下列物质的溶液加热蒸干、灼烧后,所得的固体成份不相同的是()
| A.FeCl2、FeCl3 | B.NaHCO3、Na2CO3 |
| C.Al2(SO4)3、AlCl3 | D.NH4HCO3、NH4Cl |
下列生产、生活等实际应用,不能用勒夏特列原理解释的是()
| A.合成氨的反应温度控制在500℃进行 |
| B.用难溶FeS固体除去工业废水中的Pb2+ |
| C.打开碳酸饮料会有大量气泡冒出 |
| D.实验室用排饱和食盐水的方法收集氯气 |
在0.10 mol·L—1CH3COOH溶液中存在如下电离平衡:
CH3COOH CH3COO—+H+对于该平衡,下列叙述正确的是()
CH3COO—+H+对于该平衡,下列叙述正确的是()
| A.加水稀释时,溶液中所有离子的浓度随之减小 |
| B.加入少量NaOH固体,平衡向正反应方向移动 |
| C.加入少量0.10 mol·L—1HCl溶液,溶液中c(H+)不变 |
| D.加入少量CH3COONa固体,平衡向正反应方向移动 |
把1mL0.1mol/L的H2SO4加水稀释制成2L溶液,在此溶液中由水电离产生的H+,
其浓度接近于()
A.1×10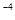 mol/L mol/L |
B.1×10 mol/L mol/L |
C.1×10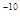 mol/L mol/L |
D.1×10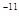 mol/L mol/L |
下列液体均处于25℃,有关叙述正确的是()
| A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐 |
| B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 |
| C.AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 |
D.NaHCO3溶液中:c( Na+)=2c(CO Na+)=2c(CO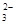 )+c(HCO )+c(HCO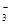 )+c(H2CO3) )+c(H2CO3) |