已知NaHSO4在水中的电离方程式为:NaHSO4=Na++H++SO42-。某温度下,向pH=6的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的pH为2。下列对该溶液的叙述中,不正确的是( )
| A.该温度高于25℃ |
| B.由水电离出来的H+的浓度是1.0×10-10mol·L-1 |
| C.NaHSO4晶体的加入抑制了水的电离 |
| D.该温度下加入等体积pH为12的NaOH溶液可使该溶液恰好呈中性 |
将反应IO3-+5I-+6H+ 3I2+3H2O设计成如下图所示的原电池,甲、乙烧杯中都加入淀粉溶液。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是()
3I2+3H2O设计成如下图所示的原电池,甲、乙烧杯中都加入淀粉溶液。开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转。下列判断不正确的是()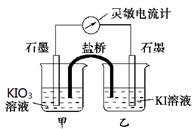
| A.两次电流计指针偏转方向相反,电流计读数为零时,反应达到化学平衡状态 |
| B.两次实验中,盐桥中的阳离子移动方向相反 |
| C.开始加入少量浓硫酸时,只有乙烧杯中溶液变蓝。 |
| D.向甲烧杯中滴入几滴浓NaOH溶液后,乙中石墨电极上发生还原反应 |
常温时0.1 mol·L-1 HA溶液的pH=3, 0.1 mol·L-1 BOH溶液中c(OH-)∶c(H+)=1012,将两溶液等体积混合,以下判断正确的是()
A.c(H+)+c(HA)=c(OH-)
B.c(OH-)<c(H+)<c(B+)<c(A-)
C.c(H+)+c(B+)<c(A-)+c(OH-)
D.c(A-)=c(B+)>c(H+)=c(OH-)
右图试管中盛有酸雨浸泡过的铁钉,U形管中盛有一段红墨水。开始时U型管左端红墨水水柱下降,一段时间后U型管左端红墨水水柱又上升。下列说法不正确的是()
| A.开始时发生的是析氢腐蚀 |
| B.—段时间后发生的是吸氧腐蚀 |
| C.两段时间内负极的电极反应相同 |
| D.两段时间内正极的电极反应相同 |
有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入B的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为()
A.D>C>A>BB.B>A>D>C
C.D>A>B>CC.D.D>B>A>C
下列有关金属腐蚀与防护的说法不正确的是()
| A.纯银器表面在空气中因化学腐蚀渐渐变暗 |
| B.当镀锌铁制品的镀层破损时,镀层仍能对铁制品起保护作用 |
| C.在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 |
| D.可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀 |