在标准状况下,将aLNH3完全溶于水得到VmL氨水,溶液的密度为ρg·cm-3,溶质的质量分数为ω,溶质的物质的量浓度为C mol/L。下列叙述中正确的是( )
①ω= ②C=
②C=
③ 上述溶液中再加入VmL水后,所得溶液的质量分数大于0.5ω
④上述溶液中再加入1.5VmL同浓度稀盐酸,充分反应后溶液中离子浓度大小关系为:
C(Cl-)>C(NH4+)>C(H+)>C(OH-)
| A.①④ | B.②③ | C.①③ | D.②④ |
用胶头滴管向用石蜡围成的“spark”凹槽内注入某溶液,即可在玻璃上刻蚀出“spark”的字样,则该溶液是()
| A.盐酸 | B.氢氟酸 | C.烧碱 | D.饱和食盐水 |
下列有关实验装置的说法中正确的是()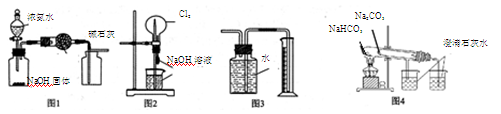
| A.图1装置可制取、收集干燥纯净的NH3 |
| B.图2装置可以完成“喷泉”实验 |
| C.图3装置可测量Cu 与浓硝酸反应产生气体的体积 |
| D.图4装置可用比较NaHCO3和Na2CO3的热稳定性 |
解释下列事实的离子方程式不正确的是()
A.Cu与浓H2SO4反应放出气体: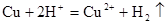 |
B.用大理石与稀盐酸制备CO2: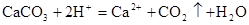 |
C.稀H2SO4与BaCl2溶液反应生成沉淀: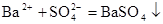 |
D.盛放NaOH溶液的试剂瓶不能用玻璃塞: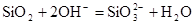 |
下列各组离子能大量共存的是()
A. 、 、 、 、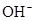 、 、 |
B.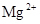 、 、 、 、 、 、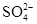 |
C.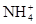 、 、 、 、 、 、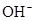 |
D. 、 、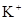 、 、 、 、 |
用NA表示阿伏加德罗常数的值,下列说法正确的是()
| A.标准状况下,11.2 LO2和O3组成的混合气体含有原子数为NA |
| B.常温常压下,1.7 g NH3含有的电子数目为 NA |
| C.0.1mol/LNa2SO4溶液中含有Na+的个数为0.2NA |
| D.常温常压下,22.4 LCO2与足量Na2O2反应转移电子数为 NA |