下列有关原电池和金属腐蚀的说法错误的是
| A.普通锌锰干电池碳棒是负极,锌片是正极 |
| B.盛水的铁器,在空气与水交界处更容易锈蚀 |
| C.为防止金属的腐蚀可在金属表面涂油漆、油脂 |
| D.用盐酸与锌反应制取氢气,含有杂质的锌比纯锌产生氢气速度快 |
在一定条件下,RO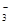 与R-可发生反应:RO
与R-可发生反应:RO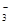 +5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
+5R-+6H+===3R2+3H2O,下列关于R元素的叙述中,正确的是( )
| A.元素R位于周期表中第ⅤA族 |
B.RO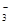 中的R只能被还原 中的R只能被还原 |
| C.R2在常温常压下一定是气体 |
D.若1 mol RO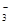 参与该反应,则转移的电子的物质的量为5 mol 参与该反应,则转移的电子的物质的量为5 mol |
反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1;反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表。
FeO(s)+H2(g)的平衡常数为K2。在不同温度时K1、K2的值如下表。
| 温度(K) |
K1 |
K2 |
| 973 |
1.47 |
2.38 |
| 1 173 |
2.15 |
1.67 |
下列说法正确的是( )
A.反应①是放热反应 B.反应②是放热反应
C.反应②在973 K时增大压强,K2增大 D.在常温下反应① 一定能自发进行
反应N2O4(g)  2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是( )
2NO2(g) ΔH=+57 kJ·mol-1,在温度为T1、T2时,平衡体系中NO2的体积分数随压强的变化曲线如图所示。下列说法正确的是( )
| A.a 、c两点的反应速率:a>c | B.a 、c两点气体的颜色:a深、c浅 |
| C.由状态b到状态a ,可以用加热的方法 | D.a、c两点气体的平均相对分子质量:a>c |
在容积不变的密闭容器中进行反应:2SO2(g)+O2(g) 2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
2SO3(g) ΔH<0。下列各图表示当其他条件不变时,改变某一条件对上述反应的影响,其中分析正确的是( )
| A.图Ⅰ表示温度对化学平衡的影响,且甲的温度较高 |
| B.图Ⅱ表示t0时刻使用催化剂对反应速率的影响 |
| C.图Ⅱ表示t0时刻通入氦气对反应速率的影响 |
| D.图Ⅲ表示t0时刻增大O2的浓度对反应速率的影响 |
已知:HCN(aq)与NaOH(aq)反应的∆H=-12.1kJ/mol;HCl(aq)与NaOH(aq)反应的∆H=-55.6kJ/mol。则HCN在水溶液中电离的∆H等于( )
| A.-67.7 kJ/mol | B.-43.5 kJ/mol | C.+43.5 kJ/mol | D.+67.7kJ/mol |