镁砂(MgO)是一种高温耐火材料。下图是氨法制取高纯镁砂的部分工艺流程:
 |
请回答:
(1)MgCl2•6H2O溶于水,溶液呈 (填“酸性”、“中性”、或“碱性”)。
(2)写出氨分子的电子式 。
(3)蒸氨是将石灰乳通入氯化铵溶液中,并加热,写出该反应的化学方程式: 。
(4)轻烧后的产物为 。
(5)工业获取的MgCl2•6H2O常混有FeCl3,除去MgCl2溶液中的Fe3+,可选用下列试剂
| A.MgO | B.NaOH | C.Mg(OH)2 | D.KSCN |
(6)氨化反应过程中反应的离子方程式 。
(7)过滤洗涤主要是除去附着在固体表面的氯离子,过滤后洗涤沉淀的方法是 ;
检验沉淀已洗涤干净的方法是 。
某学生用下图所示装置证明溴和苯的反应是取代反应而不是加成反应。主要实验步骤如下: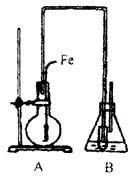
⑴检查气密性,然后向烧瓶中加入一定量的苯和液溴。
⑵向锥形瓶中加入某溶液适量,小试管中加入CCl4,并将右边的长导管口浸入CCl4液面下。
⑶将A装置中的纯铁丝小心向下插入混合液中。
请填写下列空白:
①装置B的锥形瓶中小试管内CCl4的作用是 _;小试管外的液体是(填名称)___________,其作用是__ _________。
②反应后,向锥形瓶中滴加(填化学式)___________溶液,现象是___________,其作用是___________;装置(Ⅱ)还可起到的作用是_________
某化学研究小组探究无水三草酸合铁酸钾K3[Fe(C2O4)3]受热分解的产物,并对所得气体产物和固体产物进行验证,按下图装置进行实验(夹持仪器已略去)。
(1)连接好装置后,加入药品前,应该进行的实验操作是________________(填操作名称)。
(2)实验开始时缓缓通入氮气,过一段时间以后,加热反应管A和E ,待反应完全后,停止加热,仍继续通氮气,直到反应管冷却。停止加热前是否需要先断开A、B的连接处和E、F的连接处?为什么?_______________________________________________________________。
(3)实验中观察到B中澄清石灰水变浑浊,则说明气体产物中有(写化学式)。
能证明分解产物中有CO气体生成的实验现象是。
(4)该小组同学查阅资料后得知,固体产物中不存在+3价Fe元素,而盐类物质只有K2CO3。
① 验证固体产物中钾元素存在的方法是,现象是。
② 研究小组为探究铁元素的存在形式,取A中充分反应后所得固体于试管中,加入足量蒸馏水,过滤、洗涤、干燥得到黑色粉末,取4.4g黑色粉末溶于足量稀硝酸中,收集到标准状况下NO气体1.12L通过计算判断黑色粉末的成分为(写化学式)。写出黑色粉末溶于足量稀硝酸发生反应的离子方程式。
谷氨酸一钠盐是味精的主要成分,谷氨酸一钠盐在水溶液中存在如下平衡:
⑴当前我国生产味精主要采用淀粉发酵法,其中第一步是使淀粉水解为单糖。实验室中检验淀粉水解产物可选用的试剂是。
| A.NaOH溶液、氨水、AgNO3溶液 | B.H2SO4溶液、氨水、AgNO3溶液 |
| C.NaOH溶液、CuSO4溶液 | D.H2SO4溶液、CuSO4溶液 |
⑵“沙伦逊甲醛滴定法”可用于测定味精中谷氨酸一钠盐的含量。其方法如下:
将一定质量的味精样品溶于水,再向溶液中加入36%甲醛溶液,发生的反应如下:
R—NH2+HCHO→R—N=CH2+H2O(R表示除“-NH2”外的基团),再以酚酞为指示剂,用NaOH溶液进行滴定。
①上述测定过程中加入甲醛的目的是。
②滴定终点的实验现象为。
⑶味精中常含食盐,有两个同学分别设计甲、乙两种方案来测定味精中NaCl的含量。
①甲方案:取一定质量味精样品溶于水,加入足量稀硝酸酸化的硝酸银溶液,充分反应后,(填写操作步骤),称量沉淀质量。
②乙方案:取mg味精溶于水,加入过量浓度为c1mol·L—1的AgNO3溶液,再加入少量溶液做指示剂,用浓度为c2mol·L—1的NH4SCN溶液进行滴定,当溶液变为红色时,达到滴定终点。已知:AgSCN是难溶于水的沉淀。
设测定过程中所消耗的AgNO3溶液和NH4SCN溶液的体积分别为V1mL和V2mL,则该味精样品中NaCl的质量分数是。
(15分)碱式碳酸铜的成分有多种,其化学式一般可表示为xCu(OH)2·yCuCO3。
⑴孔雀石呈绿色,是一种名贵的宝石,其主要成分是Cu(OH)2·CuCO3。某兴趣小组为探究制取孔雀石的最佳反应条件,设计了如下实验:
实验1:将2.0mL 0.50 mol·L—1的Cu(NO3)2溶液、2.0mL 0.50 mol·L—1的NaOH溶液和0.25 mol·L—1的Na2CO3溶液按表Ⅰ所示体积混合。
实验2:将合适比例的混合物在表Ⅱ所示温度下反应。
实验记录如下:
| 编号 |
V (Na2CO3)/ mL |
沉淀情况 |
编号 |
反应温度/℃ |
沉淀情况 |
|
| 1 |
2.8 |
多、蓝色 |
1 |
40 |
多、蓝色 |
|
| 2 |
2.4 |
多、蓝色 |
2 |
60 |
少、浅绿色 |
|
| 3 |
2.0 |
较多、绿色 |
3 |
75 |
较多、绿色 |
|
| 4 |
1.6 |
较少、绿色 |
4 |
80 |
较多、绿色(少量褐色) |
表Ⅰ表Ⅱ
①实验室制取少许孔雀石,应该采用的条件是。
②80℃时,所制得的孔雀石有少量褐色物质的原因是。
⑵实验小组为测定上述某条件下所制得的碱式碳酸铜样品组成,利用下图所示的装置(夹持仪器省略)进行实验: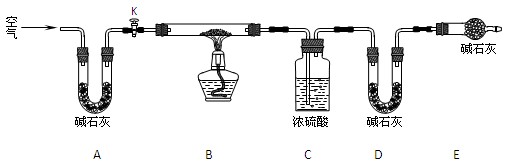
步骤1:检查装置的气密性,将过滤、洗涤并干燥过的样品置于平直玻璃管中。
步骤2:打开活塞K,鼓入空气,一段时间后关闭,称量相关装置的质量。
步骤3:加热装置B直至装置C中无气泡产生。
步骤4:。
步骤5:称量相关装置的质量。
①装置A的作用是;若无装置E,则实验测定的x/y的值将(选填“偏大”、“偏小”或“无影响”)。
②某同学在实验过程中采集了如下数据:
A.反应前玻璃管与样品的质量163.8g
B.反应后玻璃管中残留固体质量56.0g
C.装置C实验后增重9.0g
D.装置D实验后增重8.8g
为测定x/y的值,你认为可以选用上述所采集数据中的(写出所有组合的字母代号)一组即可进行计算,并根据你的计算结果,写出该样品组成的化学式。
某课外活动小组为了测定某氯化锶(SrCl2)样品的纯度,设计了如下方案:
称取1.0g样品溶解于适量水中,向其中加入含AgNO32.38g的AgNO3溶液(溶液中除Cl―外,不含其它与Ag+反应生成沉淀的离子),Cl―即被全部沉淀。然后用含Fe3+的溶液作指示剂,用0.2mol/L的NH4SCN标准溶液滴定剩余的AgNO3,使剩余的Ag+以AgSCN白色沉淀的形式析出,以测定氯化锶样品的纯度。请回答下列问题:
(1)滴定反应达到终点的现象是;
(2)实施滴定的溶液以呈(选填“酸性”、“中性”或“碱性”)为宜,加
(填化学式)试剂可达到这一目的;
(3)在终点到达之前的滴定过程中,两种沉淀表面会吸附部分Ag+,需不断剧烈摇动锥形瓶,否则会使n (Clˉ)的测定结果(选填“偏高”、“偏低”或“无影响”);
(4)到达终点后,则必须轻轻摇动锥形瓶,(此时不得剧烈摇动)以减少误差,否则这种误差会使n (Clˉ)测定值偏低,这说明两者的溶解度:AgCl AgSCN(填“>”或“<”);
(5)若以Fe3+的溶液作指示剂,用NH4SCN标准溶液滴定剩余的AgNO3时,用去上述浓度的NH4SCN溶液20.0mL,则原氯化锶样品的纯度为。