下图是一个制取氯气并以氯气为原料进行特定反应的装置:
(1)A是氯气发生装置,化学反应方程为
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,连接上E装置。Cl2通过C瓶后再进入
| A.D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:。装置C的作用是。 (3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是。 (4)若将E处烧杯中溶液改为澄清石灰水,反应过程现象为。(填代号) |
||
| B.有白色沉淀生成 | C.无现象 | D.先生成白色沉淀,而后白色沉淀消失 |
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是 ,
B的作用是 。
某粗氧化铜样品中含少量氧化亚铁及不溶于酸的杂质,某化学兴趣小组利用该样品制取胆矾晶体,测定胆矾晶体中结晶水的含量,并计算样品中氧化铜的含量,设计了如下方案进行实验。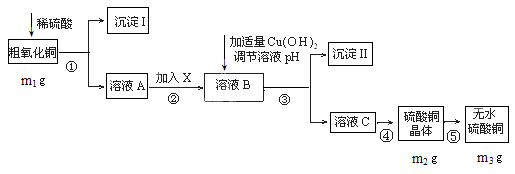
查阅资料知Fe3+、Cu2+、Fe2+在水溶液中形成氢氧化物沉淀的pH范围如下: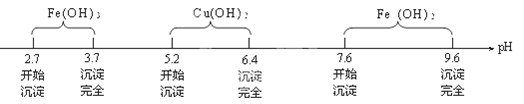
请回答下列问题:
(1)在整个实验过程中,下列仪器中不可能用到的是__________(填编号)。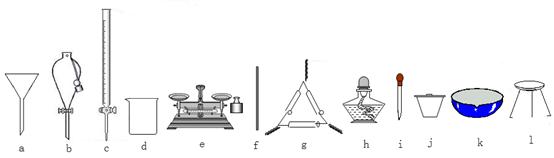
(2)物质X应选用_________(填字母)。
a.氢氧化钠b.双氧水 c.铁粉 d.高锰酸钾
(3)为保证沉淀Ⅱ沉淀完全,操作③中溶液pH的调节范围为。
(4)操作④的步骤有、冷却结晶、、自然干燥。
(5)在测定所得胆矾(CuSO4·xH2O)中结晶水x值的实验过程中:称量操作至少进行__次若测定结果x值偏大,可能的原因是_______________。
a.加热温度过高
b.胆矾晶体的颗粒较大
c.加热后放在空气中冷却
d.加热胆矾晶体时有晶体从坩埚中溅出
(6)该小组一位同学根据实验结果求出样品中CuO的质量分数为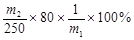 ,另一位同学不同意,其原因是。
,另一位同学不同意,其原因是。
Ⅰ.实验室常用以下几种方法制取氯气
(1)二氧化锰与浓盐酸反应制氯气,写出其反应的离子方程式_________________________。
(2)高锰酸钾与浓盐酸反应制氯气,写出其反应的化学方程式_________________________。
(3)氯酸钾与浓盐酸反应制氯气,该反应中氧化产物与还原产物的物质的量之比为___________。
Ⅱ.某研究性学习小组利用下列装置制备漂白粉,并进行漂白粉有效成分的质量分数测定。
(1)装置④中的x试剂为_________________________;
(2)装置③中发生反应的化学方程式为___________________________________,该反应是放热反应,反应温度较高时有副反应发生,改进该实验装置以减少副反应发生的方法是____________________________;
(3)测定漂白粉有效成分的质量分数:称取1.000 g漂白粉于锥形瓶中,加水溶解,调节溶液的pH,以淀粉为指示剂,用0.1000 mol·L-1 KI溶液进行滴定,溶液出现稳定浅蓝色时为滴定终点。反应原理为:
3ClO-+ I-= 3Cl-+ IO3-IO3-+ 5I-+ 3H2O = 6OH-+ 3I2
实验测得数据如下表所示。
| 滴定次数 |
1 |
2 |
3 |
| KI溶液体积/mL |
19.98 |
20.02 |
20.00 |
该漂白粉中有效成分的质量分数为_______________;若滴定过程中未充分振荡溶液局部变浅蓝色时就停止滴定,则测定结果将_______________(填“偏高”、“偏低”或“无影响”) 。
为测定某亚硫酸钠样品的纯度,甲同学称取10.0g固体,进行如下实验: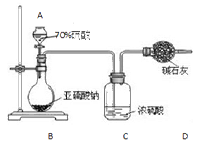
(1)实验仪器A的名称为。
(2)装置C中浓硫酸的作用是。
(3)若测得装置D中干燥管实验前后增重了4.8g,由此可计算出该样品中亚硫酸钠的纯度为。
(4)该实验方案存在明显缺陷,会使测定结果(填“偏高”或“偏低”)。为使结果准确,你的建议是。
(8分)阅读下列实验内容,根据题目要求回答问题。
实验室中有一未知浓度的稀盐酸,某学生用0.100mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。请完成下列填空:
| 实验编号 |
待测盐酸的体积(mL) |
NaOH溶液的浓度(mol·L-1) |
滴定完成时,NaOH溶液滴入的体积(mL) |
| 1 |
20.00 |
0.10 |
24.18 |
| 2 |
20.00 |
0.10 |
23.06 |
| 3 |
20.00 |
0.10 |
22.96 |
(1)滴定达到终点的标志是。
(2)根据上述数据,可计算出该盐酸的浓度约为(保留小数点后叁位)。
(3)若滴定结束时,碱式滴定管中的液面如图所示,终点读数为mL。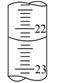
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
蒸馏是实验室制备蒸馏水的常用方法。下图是实验室制取蒸馏水的常用装置。
(1)图中明显的错误是。
(2)仪器A的名称是,仪器B的名称是。
(3)实验时,A中除加入适量自来水外,还需加入少量,其作用是。