某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①装置A中发生反应的离子方程式是 。
②整套实验装置存在一处明显的不足,请指出 。
(2)用改正后的装置进行实验,实验过程如下:
| 实验操作 |
实验现象 |
结论 |
| 打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯。 |
D装置中:溶液变红 E装置中:水层溶液变黄,振荡后,下层CCl4层无明显变化。 |
Cl2、Br2、Fe3+的氧化性由强到弱的顺序为: |
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化。D装置中:红色慢慢褪去。E装置中:CCl4层先由无色变为橙色,后颜色逐渐加深,直至变成红色。
为探究上述实验现象的本质,小组同学查得资料如下:
ⅰ.Fe3+ +3SCN- Fe(SCN)3是一个可逆反应。 Fe(SCN)3是一个可逆反应。ⅱ.(SCN)2性质与卤素单质类似。氧化性:Cl2> (SCN)2。 ⅲ.Cl2和Br2反应生成BrCl,BrCl呈红色(略带黄色),沸点约5℃,它与水能发生水解反应,且该反应为非氧化还原反应。 ⅳ.AgClO、AgBrO均可溶于水。 |
①用平衡移动原理(结合上述资料)解释Cl2过量时D中溶液红色褪去的原因 ,现设计简单实验证明上述解释:取少量褪色后的溶液,滴加 溶液,若溶液颜色 ,则上述解释是合理的。
②探究E中颜色变化的原因,设计实验如下:
用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生。请结合上述资料用两步方程式(离子或化学方程式不限定)解释仅产生白色沉淀原因 、
纳米材料二氧化钛(TiO2)可做优良的催化剂。
| 资料卡片 |
||
| 物质 |
熔点/℃ |
沸点/℃ |
| SiCl4 |
-70 |
57.6 |
| TiCl4 |
-25 |
136.5 |
Ⅰ. 工业上二氧化钛的制备方法:
① 将干燥后的金红石(主要成分为TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2反应,制得混有SiCl4杂质的TiCl4。
② 将SiCl4分离,得到纯净的TiCl4。
③ 在TiCl4中加水、加热,水解得到沉淀TiO2·xH2O。
④ TiO2·xH2O高温分解得到TiO2。
(1) 根据资料卡片中信息判断,TiCl4与SiCl4在常温下的状态是____________,分离二者所采取的操作名称是________________。
(2) ③中反应的化学方程式是________________________________________________。
(3) 若④在实验室完成,应将TiO2·xH2O放在________________(填仪器名称)中加热。
Ⅱ. 据报道:能“吃废气”的“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2―→2O b. O+H2O―→2OH c. OH+OH―→H2O2
(4) b中破坏的是______________(填“极性共价键”或“非极性共价键”)。
(5) H2O2能清除路面空气中的CxHy、CO等,主要是利用了H2O2的____________(填“氧化性”或“还原性”)。
Ⅲ. 某研究性学习小组用下列装置模拟“生态马路”清除CO的原理。(夹持装置已略去)
(6) 若缓慢通入22.4L(已折算成标准状况)CO气体,结果NaOH溶液增重16.5g,则CO的转化率为___ _________。
_________。
(7) 当CO气体全部通入后,还要通一会儿空气,其目的是 。
近期研究证实,中药甘草中的异甘草素在药理实验中显示明显的促进癌细胞凋亡和抑制肿瘤细胞增殖的活性,且对正常细胞的毒性低于癌细胞。异甘草素可以由有机物A和有机物B合成(A、B均为芳香族含氧衍生物),且由A和B合成异甘草素要用到以下反应:(R1、R2均为烃基)
请回答下列问题:
(1)有机物B分子式为C7H6O2,A和B均能与浓溴水反应生成沉淀。A和B具有一种相同的含氧官能团,其名称为;B分子中有四种不同的氢原子,其个数比为2∶2∶1∶1。以下说法正确的是(填序号)。
①有机物B能发生很多类型的反应,例如:中和、取代、氧化、还原、加成反应
②与B互为同分异构体的芳香族含氧衍生物共有两种(不包含B)
③B能与碳酸氢钠溶液反应放出二氧化碳气体
(2)质谱表明有机物A相对分子质量为152,其碳、氢、氧元素的质量分数比为12∶1∶6。有机物A的分子式为;已知A分子中的官能团均处于间位,写出A、B合成异甘草素的化学方程式 。
。
(3)初步合成的异甘草素需要经过以下处理工艺;
I加入一定量的水,再加入一定量的乙醚提取2次
II用无水MgSO4干燥、过滤减压蒸出。
III洗涤、浓缩得黄色粉末,再用含水乙醇处理得黄色针状晶体。
步骤II蒸出的物质中除了目标产物还含有;上处理工艺中涉及的分离提纯操作依次为:。
(4)有机物D符合下列条件,写出D的结构简式。
①与A互为同分异构体,且能发生水解反应
②1molD能与3moNaOH反应
③苯环上的氢被氯取代的一氯代物有两种
(5)有机物B还可以发生以下变化: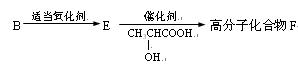
已知:F的单体是由E和 按1∶1生成,请写出E→高分子化合物F的化学方程式;该反应类型属于。
按1∶1生成,请写出E→高分子化合物F的化学方程式;该反应类型属于。
洗车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅含Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸。
取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另外一种单质。化合物丙置于空气中可转化为可溶性盐和一种气态单质。
请回答下列问题:
(1)甲的化学式为,丙的电子式为。
(2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为;
将该碳酸氢盐溶于水配成溶液,则溶液中各离子浓度大小关系为:。
(3)单质乙与红棕色粉末发生反应的化学方程式为,安全气囊中红棕色粉末的作用是。
(4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是。
| A.KCl | B.KNO3 | C.Na2S | D.CuO |
I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是(填序号)。
| A.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂并中; |
| B.制备氢氧化铁胶体时,应向20mL沸水中逐滴滴加1~2mL饱和的FeCl3溶液,并继续加热到液体呈透明的红褐色为止; |
C.在石油的分馏实验中,温度 计需插入液体中; 计需插入液体中; |
| D.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液; |
E用酸式滴定管量取20.00mL高锰酸钾酸性溶液;
F.在进行中和热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、取用的碱溶液略过量、进行两到三次实验取平均值。
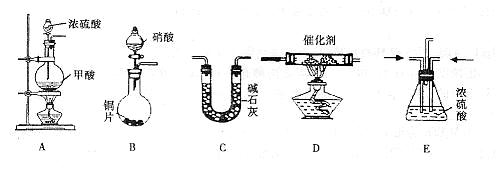
II.汽车尾气的主要成分为CO2及CO、NOX(NO和NO2)的混合物,其中NO的体积分数占95%以上)等。治理方法之一是在汽车排气管上加装“催化转换器”,利用催化剂使CO和NOX发生反应大部分转化为CO2和N2。某小组在实验室利用下图所示装置模拟处理汽车尾气中CO和NOX的反应并测量反应后混合气体的组成。(已知 )
)
试回答下列问题:
(1)仪器的连接顺序为
(2)E装置的作用是___________________、___________________________________________。
(3)写出D中的NOX与CO反应的化学方程式______________________________________。
(4)若B容器中生成的NOX为NO,写出该反应的化学方程式,并标出电子转移的方向和数目_____________________________ ____________________________。
____________________________。
(5)若通入的NOX为NO,C装置增重8.8g,收集到的气体在标准状况下为4.48L(其相对分子质量为28.4)。则收集到的气体中NO的物质的量为___________________。
(6)选择高效催化剂,将汽车尾气转化为无毒气体,便彻底解决了汽车尾气对环境的影响,这种说法是否正确并阐述理由:___________________________________________。
黄铁矿是我国大多数硫酸厂制取硫酸的主要原料。某化学兴趣小组对某黄铁矿石(主要成分为FeS2)进行硫元素含量测定的实验探究及工业生产硫酸的探究.
I.将m1g该黄铁矿样品(杂质中不含硫和铁)放入如下图所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通人空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2+11O2→2 Fe2O3+8SO2(高温)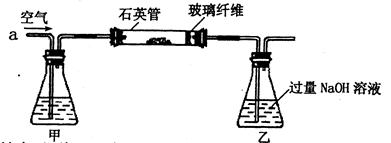
Ⅱ.反应结束后,将乙瓶中的溶液进行如下处理: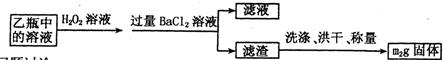
问题讨论:
(1)1中,甲瓶内所盛试剂是溶液。乙瓶内发生反应的离子方程式有
、。
(2)Ⅱ中,所加H2O2溶液需足量的理由是。
(3)该黄铁矿石中硫元素的质量分数为。
(4)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫: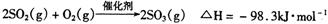 在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2
在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2 的转化率为。
的转化率为。
(5)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体间进行了“对流”。请简单描述吸收塔中反应物之间是怎样对流的。
②工业生产中常用氨一酸法进行尾气脱硫,以达到消除污染、废物利用的目的,用化学方程式表示其反应原理。(只写出2个方程式即可)