(14分)(1)已知:
Fe(s)+1/2O2(g)=FeO(s) 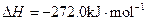
2Al(s)+3/2O2(g)= Al2O3(s) 
Al和FeO发生铝热反应的热化学方程式是________________________________________。
(2)反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示。
①据图判断该反应是_____(填“吸”或“放”) 热反应,当反应达到平衡后,其他条件不变,升高温度,反应物的转化率__ _ _ (填“增大”、“减小”或“不变”)
②其中B历程表明此反应采用的条件为______ (选填下列序号字母)
A、升高温度 B、增大反应物的浓度
C、降低温度 D、使用了催化剂
(3) 1000℃时,硫酸钠与氢气发生下列反应:Na2SO4(s) + 4H2(g)  Na2S(s) + 4H2O(g) 。
Na2S(s) + 4H2O(g) 。
①该反应的平衡常数表达式为____________________。已知K1000℃<K1200℃,则该反应是________反应(填“吸热”或“放热”)。
②用有关离子方程式说明上述反应所得固体产物的水溶液的酸碱性_______ _____
(4)常温下,如果取0.1mol·L-1HA溶液与0.1mol·L-1NaOH溶液等体积混合(混合后溶液体积的变化忽略不计),测得混合液的pH=8,请回答下列问题:
①混合溶液中水电离出的c(H+)与0.1mol·L-1NaOH溶液中水电离出的c(H+)比较
(填<、>、=)。
②已知NH4A溶液为中性,又知将HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH 7(填<、>、=);相同温度下,等物质的量浓度的下列四种盐溶液按pH由大到小的排列顺序为 。(填序号)
a.NH4HCO3 b.NH4A c.(NH4)2CO3 d.NH4Cl
在密闭容器中,保持一定温度进行如下反应N2(g)+3H2(g) 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3(见下表中编号①的一行)。若相同条件下,达到平衡时混合物中各组分的百分含量不变。回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填字母序号)。
| A.N2的转化率越高 | B.NH3的产量越大 |
| C.正反应进行得越彻底 | D.化学反应速度越快 |
(3)a与b的关系是:ab(填>、<、=)
(4)填写下表:
| 状态 条件 |
起始时物质的物质的量(mol) |
平衡时NH3的物质的量 (mol) |
|||
| 编号 |
X(N2) |
Y(H2) |
Z(NH3) |
||
| 恒容 |
① |
1 |
3 |
0 |
b |
| ② |
0 |
0 |
b |
||
| ③ |
2.25 |
b |
如图是一个化学过程的示意图。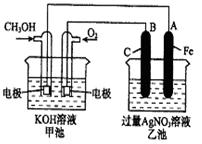
已知甲池的总反应式为:2CH3OH+3O2+4KOH
(1)请回答图中甲、乙两池的名称。
甲电池是装置,乙池是装置。
(2)请回答下列电极的名称:
通入CH3OH的电极名称是,B(石墨)电极的名称是。
(3)写出电极反应式:
通入O2的电极的电极反应式是。A(Fe)电极的电极反应式为
,
(4)乙池中反应的化学方程式为。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2mL(标准状况下)
(12分)北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。由丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H1="+156.6" kJ·mol-1
CH3CH=CH2(g)= CH4(g)+HC≡CH(g) △H2=" +32.4" kJ·mol-1
(1) 相同条件下,反应C3H8(g) =CH3CH=CH2(g)+H2(g)的△H=kJ·mol-1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通人O2和CO2,负极通人丙烷,电解质是熔融碳酸盐。电池正极的电极反应式为;放电时,CO32-移向电池的(填“正”,或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2,溶于水达到平衡时,溶液的pH=5.6,c(H2CO3)=l.5×10-5mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+ H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
HCO3-+ H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
已知一个碳原子上连有两个羟基时,其结构极不稳定,易发生下列变化,生成较稳定物质如:
A—F是六种有机化合物,它们之间的关系如下图,请根据要求回答:
(1)在一定条件下,经反应①后,生成C和D,C的分子式为,反应①的类型为。
(2)反应③的化学方程式为.
(3)已知B的相对分子质量为162,其完全燃烧的产物中n(CO2):n (H2O)=2:1,则B的分子式为。
(4)F是高分子光阻剂生产中的主要原料。F具有如下特点:①能跟FeCl3溶液发生显色反应;②能发生加聚反应;③苯环上的一氯代物只有两种。F在一定条件下发生加聚反应的化学方程式为。
(5)化合物G是F的同分异构体,属于芳香族化合物,能发生银镜反应。G有种结构,写出其中一种同分异构体的结构简式。
为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。最近有科学家提出“绿色自由”构想:把空气吹入碳酸钾溶液,然后再把CO2从溶液中提取出来,经化学反应后使之变为可再生燃料甲醇。“绿色自由”构想技术流程如下:
(1)在合成塔中,若有4.4kg CO2与足量H2恰好完全反应,可放出4947 kJ的热量,试写出合成塔中发生反应的热化学方程式是。
(2)以甲醇为燃料制作新型燃料电池,电池的正极通入O2,负极通入甲醇,在酸性溶液中甲醇与氧作用生成水和二氧化碳。该电池负极发生的反应是:
CH3OH + H2O - 6e-="===" CO2 + 6H+
则正极发生的反应是;放电时,H+移向电池的(填“正”或“负”)极。
(3)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+ 的平衡常数K=。(已知:10-5.6=2.5×10-6)
HCO3-+H+ 的平衡常数K=。(已知:10-5.6=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-) (填“>”、“=”或“<”),原因是(用离子方程式和必要的文字说明)。
(5)小李同学拟用沉淀法测定空气中CO2的体积分数,他查得CaCO3、BaCO3的溶度积(Ksp)分别为4.96×10-9、2.58×10-9。小李应该选用的试剂是___________________。