在密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)△H3= (用含a、b的代数式表示)
(2)反应①的化学平衡常数表达式K= ,已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为 ,CO的平衡浓度为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
(4)下列图像符合反应①的是 (填序号)(图中ν是速率、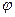 为混合物中CO含量,T为温度)。
为混合物中CO含量,T为温度)。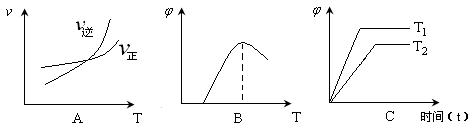
已知A、B、C、D、E、F都是周期表中前四周期的元素。它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴离子具有相同的电子层结构。F3+离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)
(1)写出C原子的价层电子排布图,F位于周期表区。
(2)A、B、C的第一电离能由小到大的顺序为。(写元素符号)
(3)F和质子数为25的M的部分电离能数据列于下表
| 元素 |
M |
F |
|
| 电离能(kJ·mol-1) |
I1 |
717 |
759 |
| I2 |
1509 |
1561 |
|
| I3 |
3248 |
2957 |
比较两元素的I2、I3可知,气态M2+再失去一个电子比气态F2+再失去一个电子难。对此,你的解释是。
(4)晶胞中F原子的配位数为,若F原子的半径为rcm,则F晶体的密度为(用含r的表达式表示),该晶胞中原子空间利用率为。
(5)H2S和C元素的氢化物(分子式为H2C2的主要物理性质比较如下
| 熔点/K |
沸点/K |
标准状况时在水中的溶解度 |
|
| H2S |
187 |
202 |
2.6 |
| H2C2 |
272 |
423 |
比任意比互溶 |
H2S和H2C2的相对分子质量基本相同,造成上述物理性质差异的主要原因。
某工厂的废水中含有FeSO4、H2SO4、Ag2SO4、Al2(SO4)3及一些污泥。某研究性学习课题组测定了废水中各物质的含量并查找了溶解度数据,现列表如下
表一废水中各物质的含量
| 物质 |
FeSO4 |
H2SO4 |
Ag2SO4 |
Al2(SO4)2 |
污泥 |
| 质量分数/(%) |
15.0 |
7.0 |
0.40 |
0.34 |
5.0 |
表二 FeSO4和Al2(SO4)3在水中的溶解度
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
| FeSO4溶液度(g) |
15.6 |
20.5 |
26.5 |
32.9 |
40.2 |
48.6 |
| Al2(SO4)3溶解度(g) |
31.2 |
33.5 |
36.4 |
40.4 |
45.7 |
52.2 |
该课题组根据表中数据,设计了污水处理方案,拟利用该厂的废铁屑(有少量锈斑)、烧碱溶液和硫酸处理此污水,回收FeSO4·7H2O和Ag。
(1)请填写下列空白,完成得到Ag的实验方案:
①将带有锈斑的废铁屑先后用热的烧碱溶液和热水进行洗涤,目的是。
②将工厂废水过滤,用少量水洗涤滤渣,洗涤液并入滤液后保留待用;
③,目的是使Ag+全部还原为金属Ag;
④,目的是分离出Ag;
(2)请写出后续的步骤,除去Al3+,得到主要成分为FeSO4·7H2O晶体。
⑤将第步与第④步所得滤液混合后,加入少量硫酸至混合液的pH为3-4后,,滤出FeSO4·7H2O晶体
(3)写出步骤③中所有化学反应的离子方程式。
(4)在步骤⑤中,加入少量硫酸调节pH的目的是。
与甲醇燃料电池相比,乙醇燃料电池具有毒性低、理论能量密度高等优点,因此被广泛认为是更有前途的燃料电池。右图是一个乙醇燃料电池工作时的示意图。乙池中的两个电极均为石墨电极,乙池中盛有100mL3.00mol/L的CuSO4溶液。请回答下列问题: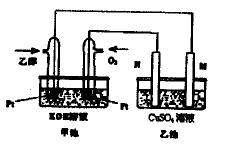
(1)N的电极反应式为。
(2)在此过程中,乙池中某一电极析出金属铜6.4g时,甲池中理论上消耗氧气L(标准状况下)。
(3)在此过程中,若乙池中两电极产生的气体体积恰好相等时(标准状况下),理论上需通入乙醇g。
(4)工业上可以利用下列反应制取乙醇:
反应I:2CO2(g)+6H2(g)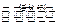 CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时.K=2.95×1011
反应II:2CO2(g)+4H2(g)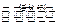 CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
CH3CH2OH(g)+H2O(g)25℃时,K=1.7l×1022
①写出反应I的平衡常数表达式K=,
②条件相同时,反应I与反应II相比,转化程度更大的是。
③在一定压强下,测得反应I的实验数据如下表: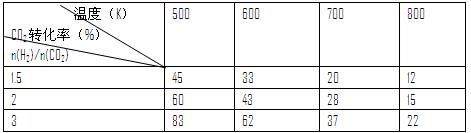
根据表中数据分析:
温度升高,K值(填“增大”、“减小”或“不变”),提高氢碳比。n(H2)/n(CO2),对生成乙醇(填“不利”或“有利”)。
某烃的含氧衍生物A能发生如下图所示的变化。已知A的蒸气密度是相同条件下H2的88倍,已知该有机物含氧27.3%。C的所有碳原子在同一平面上,J分子中所有碳原子在一条直线上,H遇FeCl3溶液显紫色。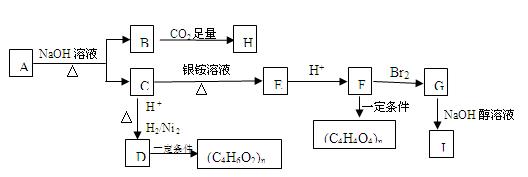
(1)A的分子式为。A→B+C的反应方程式为。
(2)写出由B生成H的反应方程式为。
(3)与D具有相同官能团的同分异构体有几种:。
(4)G的结构简式为,由G到J的反应类型为。
在下列物质转化关系中,反应的条件和部分产物已略去。其中A为常用的溶剂,B为常见的有色气体单质。
回答下列问题:
Ⅰ.若甲、乙是两种常见金属,反应Ⅲ是工业制盐酸的 反应。
反应。
(1)反应Ⅰ中,甲在通常条件下和A剧烈反应,除丙外,还生成一种焰色反应为黄色的物质,则工业上生产甲的一般方法是 。
A.热分解法 B.热还原法 C.电解法
(2)反应Ⅱ中,乙与A在高温下反应,除丙外,还生成一种有磁性的物质,则反应Ⅱ的化学方程式是 。
(3)通过比较反应Ⅰ、Ⅱ的反应条件,可得出甲的金属性比乙的金属性 (填“强”或“弱”),比较二者金属性强弱的依据还可以是 (写出一种即可)。
(4)将2.5g甲的碳酸盐、碳酸氢盐和氢氧化物的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示: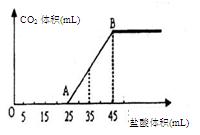
①写出OA段所发生反应的离子方程式 。
②当加入35mL盐酸时,产生CO2的体积为 mL(标准状况)。
Ⅱ.若甲、乙是化合物,反应Ⅲ是工业制漂白液的反应,其中乙为非极性键的离子化合物,写出A与乙反应的化学方程式;