龙胆酸甲酯是制取抗心律失常药物——氟卡尼的中间体。
I、已知龙胆酸甲酯结构如图所示。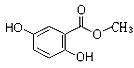
(1)龙胆酸甲酯的分子式为 ,它的含氧官能团名称为 。
(2)下列有关龙胆酸甲酯的描述,不正确的是 (填字母)。
| A.不能发生消去反应 | B.难溶于水 |
| C.能与溴水反应 | D.能与碳酸钠溶液反应产生二氧化碳 |
(3)龙胆酸甲酯与足量氢氧化钠溶液反应的化学方程式是
。(不用写反应条件)
II、已知X及其他几种有机物存在如下转化关系,且测得转化过程中的C4H8为纯净物: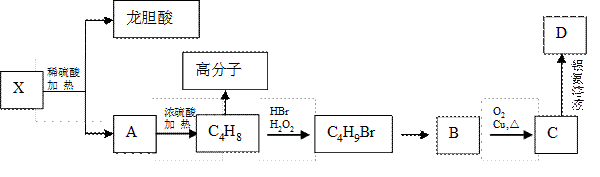
回答以下问题:
(4)写出满足下列条件的龙胆酸的一种同分异构体的结构简式
①能发生银镜反应;②能使FeCl3溶液显色;③酯类。
(5)写出B生成C的化学方程式 ,它的反应类型是
反应。
(1) 、—CH3、
、—CH3、 都是重要的有机反应中间体,有关它们的说法正确的是_________________
都是重要的有机反应中间体,有关它们的说法正确的是_________________
| A.它们均由甲烷去掉一个氢原子所得 |
| B.它们互为等电子体,碳原子均采取sp2杂化 |
| C.CH与NH3、H3O+互为等电子体,几何构型均为三角锥形 |
D. 中的碳原子采取sp2杂化,所有原子均共面 中的碳原子采取sp2杂化,所有原子均共面 |
E.两个—CH3或一个 和一个
和一个 结合均可得到CH3CH3
结合均可得到CH3CH3
(2)锌是一种重要的金属,锌及其化合物有着广泛的应用。
①指出锌在周期表中的位置:第________周期,第________族,属于________区。
②葡萄糖酸锌[CH2OH(CHOH)4COO]2Zn是目前市场上流行的补锌剂。葡萄糖分子中碳原子杂化方式有___________;写出基态Zn原子的电子排布式___________________。
生物质能是一种洁净、可再生能源。生物质气(主要成分为 CO、CO2、H2等)与 H2混合,催化合成甲醇是生物质能利用的方法之一。
(1)上述反应的催化剂含有 Cu、Zn、Al 等元素。写出基态 Cu2+离子的核外电子排布式_______________________________________;
(2)根据等电子原理,写出 CO 分子的结构式______________________;
(3)甲醇催化氧化可得到甲醛,甲醛与新制 Cu(OH)2的碱性溶液反应生成 Cu2O 沉淀。
①甲醛分子中碳原子轨道的杂化类型为_____________________;
②甲醛分子的空间构型是__________________;
③ 1 mol 甲醛分子中 σ 键的数目为__________________。
(1)中国古代四大发明之一——黑火药,它的爆炸反应为:
2KNO3+ 3C+S A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平)
①除 S 外,上列元素的电负性从大到小依次为_________________________;
②生成物中,A 的电子式为__________________,含极性共价键的分子的中心原子轨道杂化类型____________;
③已知CN-与N2结构相似,推算HCN分子中σ键与π键数目之比为____________。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布式为_______________________________,Q2+的未成对电子数是________。
(1)某元素的基态原子最外层电子排布为3s23p2,它的次外层上电子云形状有______种,原子中所有电子占有______个轨道,核外共有_________个不同运动状态的电子。
(2)E原子核外占有9个轨道,且具有1个未成对电子,E离子结构示意图是_____________。
(3)F、G都是短周期元素,F2-与G3+的电子层结构相同,则G元素的原子序数是______,F2-的电子排布式是_______________________________。
(4)M能层上有____个能级,有____个轨道,作为内层最多可容纳______个电子,作为最外层时,最多可含有______个未成对电子。
(5)在元素周期表中,最外层只有1个未成对电子的主族元素原子处于________________族;最外层有2个未成对电子的主族元素原子处于__________________族。
已知锌与稀硫酸反应为放热反应,某学生为了探究其反应过程中的速率变化,用排水集气法收集反应放出的氢气,实验记录如下:
| 经过时间(min) |
1 |
2 |
3 |
4 |
5 |
| 氢气体积(mL) |
30 |
120 |
280 |
350 |
370 |
①反应速率最大的(即0~1 min、1~2 min、2~3 min、3~4 min、4~5 min)时间段为 ,原是 。
②反应速率最小的时间段为 ,原因是。