卤族元素包括F、Cl、Br等。
(1)下列曲线表示卤族元素某种性质随核电荷数的变化趋势,正确的是 。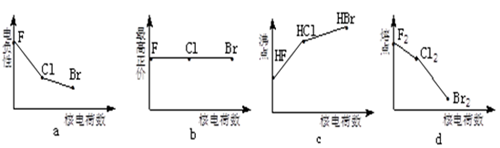
(2)利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,下图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为 ,该功能陶瓷的化学式为 。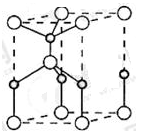
(3)BCl3和NCl3中心原子的杂化方式分别为 和 。第一电离能介于B、N之间的第二周期元素有 种。
(4)若BCl3与XYn通过B原子与X原子间的配位键结合形成配合物,则该配合物中提供孤对电子的原子是 。
将2.5g碳酸钠、碳酸氢钠和氢氧化钠固体混合物完全溶解于水,制成  稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO 2的体积(标准状况)关系如下图所示:
稀溶液,然后向该溶液中逐滴加入1mol/L的盐酸,所加入盐酸的体积与产生CO 2的体积(标准状况)关系如下图所示: 
(1)写出OA段所发生反应的离子方程式
(2)当加入35mL盐酸时,产生二氧化碳的体积为 mL(标准状况)
(3)原混合物中Na 2CO 3的质量分数为 。
某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。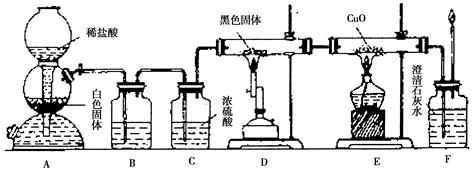
(1)装置B中最适宜的试剂是 ;
(2)装置C的作用是 ;
(3)装置D中黑色固体为碳,其反应的化学方程式为 ;
(4)根据E装置中的现象,可证明CO具有还原性,有关反应的化学方程式是 ;
;
(5)若要根据装置F中出现的现象确认一氧化碳具有还原性,应在上图装置D与E之间连接下图中的 装置(填序号)。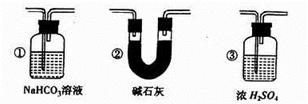
如下图所示物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%.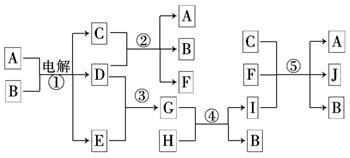
请回答下列问题:
(1)写出F的化学式:________________.
(2)人们将反应①涉及的化学工业称为 ________________.
(3)写出B与D反应的离子方程式____________________________________ ____.
____.
(4)写出反应④的离子方程式____________________________ __________________.
__________________.
(5)写出反应⑤的离子方程式_____________________________________________ _.
_.
(6)高铁酸钠(Na2FeO4)被人们认为是一种“绿色环保高效”的净水剂,其原因为:
①Na2FeO4具有强氧化性可杀菌消毒;
②___________________________________________________________________
22.A、B、C、D均为中学化学中常见的物质,它 们之间的转化关系如下图(部分产物已略去):
们之间的转化关系如下图(部分产物已略去):
试回答:
(1)若D是具有氧化性的单质,A元素属于主族金属元素,则A为________(填元素名称).
(2)若D是金属,C溶液在储存时应加入少量D,其理由是(用必要的文字和离子方程式表示)_____________ _______________________________________;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式:_________
_______________________________________;D在潮湿的空气中易发生吸氧腐蚀,写出腐蚀时原电池正极的电极反应式:_________ ___________________.
___________________.
(3)若A、B、C为含同一种金属元素的无机化合物,在溶液中A和C 反应生成 B.
反应生成 B.
请写出B转化为C的所有可能的离子方程式:________________________________、___________________________________.
某溶液 仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
仅含下表离子中的5种(不考虑水的电离及离子的水解)且各种离子物质的量均为1mol。
| 阳离子 |
Na+ Mg2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
OH- CO32- Cl- NO3- SO42- |
①若向溶液中加入KSCN溶液无明显变化;
②若向原溶液中加入稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,且溶液中阴离子种类不变;
请推断:
(1)原溶液中含有阳离子:;含有阴离子:;
(2)向原溶液中加入足量稀盐酸发生反应的离子方程式:;
(3)若向原溶液中加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为g。