氮化铝(AlN)具有耐高温、抗冲击、导热性好等优良性质,被广泛应用于电子工业、陶瓷工业等领域。在一定条件下,氮化铝可通过如下反应合成:Al2O3 + N2 + 3C 高温 2 AlN + 3CO ,下列叙述正确的是( )
| A.在氮化铝的合成反应中,N2是还原剂,Al2O3是氧化剂 |
| B.上述反应中每生成2 mol AlN,N2得到3 mol电子 |
| C.氮化铝中氮元素的化合价为—3 |
| D.氮化铝晶体属于分子晶体 |
以下是一些常用的危险品标志,装运乙醇的包装箱应贴的图标是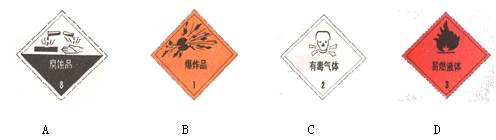
下列说法不正确的是
| A.在标准状况下,0.5molO2和0.5molN2组成的混合气体体积约为22.4L |
| B.在标准状况下,1mol任何气体的体积都约为22.4L |
| C.1molH2的质量只有在标准状况下才约为2g |
| D.273℃,101×105Pa状态下,1mol气体体积大于22.4L |
如果你家里的食用花生油混有水份,你将采用下列何种方法分离
| A.过滤 | B.蒸馏 | C.分液 | D.萃取[ |
下列说法中,正确的是
A.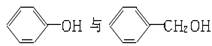 互为同系物 互为同系物 |
| B.乙醇和乙醚互为同分异构体 |
| C.乙醇、乙二醇、丙三醇互为同系物 |
| D.可用浓溴水来区分乙醇和苯酚 |
某有机物在氧气中充分燃烧 ,生成等物质的量的水和二氧化碳,则有机物必须满足的条件是
,生成等物质的量的水和二氧化碳,则有机物必须满足的条件是
A.分子中的C、H、O的个数比为1:2:3
B.该分子中肯定不含氧元素
C.该有机物的相对分子质量为14
D.分子中C、H个数比为1:2[