2 g Cu2S和CuS的混合物在酸性溶液中用400 mL 0.075 mol·L-1 KMnO4溶液处理,发生反应如下: +5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O
+5Cu2S+44H+=10Cu2++5SO2+8Mn2++22H2O +5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
+5CuS+28H+=5Cu2++5SO2+6Mn2++14H2O
反应后煮沸溶液,赶尽SO2,剩余的KMnO4恰好与350 mL 0.1 mol·L-1(NH4)2Fe(SO4)2溶液完全反应。
(1)配平KMnO4与(NH4)2Fe(SO4)2反应的离子方程式:
______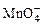 +______Fe2++______H+=______Mn2++______Fe3++______H2O
+______Fe2++______H+=______Mn2++______Fe3++______H2O
(2)KMnO4溶液与混合物反应后,剩余KMnO4的物质的量为________mol。
(3)欲配制500 mL 0.1 mol·L-1 Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M="392" g·mol-1)的质量为________g。
(4)混合物中Cu2S的质量分数为_______。
取一根镁条置于坩埚内点燃,得到氧化镁和氮化镁混合物的总质量为0.470 g,冷却后加入足量水,将反应产物加热蒸干并灼烧,得到氧化镁的质量为0.486 g。
(1)写出氮化镁与水反应生成氢氧化镁和氨气的化学方程式。
(2)计算燃烧所得混合物中氮化镁的质量分数。
标准状况下,1 L水溶解500 L氨气所得氨水的密度为0.9 g·mL-1,求此氨水的质量分数、物质的量浓度各为多少。
常温时,将a mol Cu和a mol Fe投入含b mol HNO3的浓硝酸中,经一段时间后,使它们恰好完全反应。已知反应后溶液中Fe3+和Fe2+的物质的量相等,HNO3的还原产物为NO和NO2,且不考虑NO2转化为N2O4,反应中可产生气体560 mL。将该气体溶于水,充分反应后,气体体积减少224 mL(气体体积均为标准状况下体积)。求a、b的值。〔提示:已知2Fe(NO3)3+Fe====3Fe(NO3)2〕
今用100 t氨制硝酸铵,经测定氨转化为一氧化氮的转化率为95%,二氧化氮的吸收率为98%,氨被硝酸吸收的吸收率为98%,求生成硝酸铵多少吨。
已知脊椎动物的骨骼中含有磷。以下是测定动物骨灰中磷元素含量的实验方法。称取某动物骨灰样品0.103 g,用硝酸处理,使磷转化成磷酸根。再加入某试剂,使磷酸根又转化成沉淀。沉淀经灼烧后得到组成为P2Mo24O77的固体(其相对分子质量以3.60×103计)0.504 g。试由上述数据计算该骨灰样品中磷的质量分数。(磷的相对原子质量以31.0计)