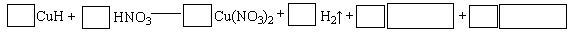(1)含10.8gAl3+的Al2(SO4)3中所含的SO42-的物质的量是 。
(2)已知16g A与20g B恰好完全反应生成0.04 mol C和31.76g D,则C的摩尔质量为 。
(3)0.1 mol Na中含 mol e-,在跟足量水反应中失去 mol e-。
(4)标准状况下V L氨气溶解在1L水中,所得溶液的密度为ρg/mL,质量分数为ω,物质的量浓度为c mol/L,则ω= 。
已知A(g)+B(g)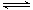 2 C(g)反应的平衡常数和温度的关系如下:
2 C(g)反应的平衡常数和温度的关系如下:
| 温度/ ℃ |
700 |
800 |
830 |
1000 |
1200 |
| 平衡常数 |
1.70 |
1.10 |
1.00 |
0.60 |
0.40 |
回答下列问题:
(1) 该反应的平衡常数表达式K=______,△H_____0(填“<”“>”“=”);
(2) 容积固定,判断该反应是否达到平衡的依据为(填正确选项前的字母):
a.气体的密度不随时间改变 b. c(A)不随时间改变
c.混合气体平均相对分子质量不随时间改变 d. 压强不随时间改变
(3)1200℃时反应2C(g) 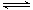 A(g)+B(g)的平衡常数的值为。
A(g)+B(g)的平衡常数的值为。
(4)830℃时,向一个10.00 L的密闭容器中充入0.40mol的A和1.60mol的B,如果反应初始2s内生成C的物质的量为0.40mol,则2s内A的平均反应速率v(A)= ____mol·L-1·s-1; 2s时c(B)= ____ mol·L-1; 2s时A的转化率为____;2s时C的体积分数为____。
(1)非金属单质A是实验室里常用的惰性电极材料,A元素原子基态时的电子排布图为。
(2)B原子基态时2p原子轨道上有3个未成对电子,下列叙述正确的是(填字母序号)
a.B的气态氢化物的沸点在同族元素的氢化物中最低
b.B的第一电离能、电负性都比A的大
c.A的气态氢化物比B的气态氢化物稳定
d.A的含氧酸一定比B的含氧酸酸性强
(3)铜单质及其化合物在很多领域有重要的用途,如超细铜粉可应用于导电材料、催化剂等领域中。超细铜粉的某制备方法如下:
①[Cu(NH3)4]SO4中,N、O、S三种元素的第一电离能从小到大的顺序为:。
②SO42-空间构型是。写出一种与SO32-互为等电子体的分子。
③NH4CuSO3中的金属阳离子的结构示意图为。
含 Mg2+、Al3+溶液10mL,向其中滴加a mLC1mol·L—1NaOH之后,改成滴加C2mol·L—1HCl,所得沉淀Y(mol)与加入的试剂总体积V(mL)间的关系如右图所示。据此,回答下列问题:
(1)C~D过程中的离子方程式;
(2)n(Mg2+)/ n(Al3+) =;
(3)C1/C2=;
(4)所加入NaOH溶液的体积a=mL。
构建知识网络是学习化学的重要方法。下列物质的转化网络可以概括几类反应,其中A、B、D、E、M、N、X、Y均表示一种中学化学中常见的无机物,反应②、③、④、⑤
的生成物可以是一种或几种。请回答下列问题: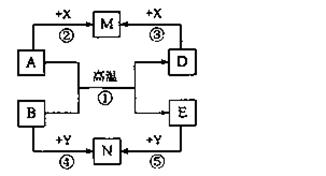
(1)A为固态非金属单质时,若反应①用于生产半导体材料,则M为________ Y为。
(2)A为金属单质时,若M为NaAlO2溶液,N为棕黄色溶液,反应⑤的离子方程式是。
(3)反应①在常温下进行时,也有很多组物质符合网络图中的转化关系,请列举一例(要求反应①中只有一种元素的化合价发生变化):A、B的化学式分别是。
某电镀铜厂有两种废水需要处理,一种废水中含有CN-离子,另一种废水中含有Cr2O72-离子.该厂拟定如图所示的废水处理流程。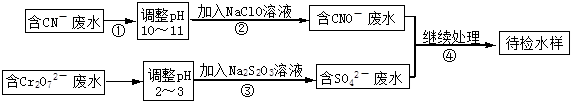 回答以下问题:
回答以下问题:
(1)步骤②发生反应的离子方程式可表示如下:aCN-+bClO-+2cOH-=dCNO-+eN2↑+fCO32-+bCl-+cH2O,上述离子方程式可能的配平系数有多组,请回答:
①方程式中e : f的值为(填选项标号)。
| A.1 | B.1/2 | C.2 | D.不能确定 |
②若d=e=1,则b=。
③若反应中转移0.6mol电子,则生成的气体在标况下的体积是。
(2)步骤③中反应时,每0.4molCr2O72-转移2.4mol的电子,该反应的离子方程式为。
(3)取少量待检水样于试管中,先加入NaOH溶液,观察到有蓝色沉淀生成,继续加入NaOH溶液,直到不再产生蓝色沉淀为止,再加入Na2S溶液,有黑色沉淀生成,且蓝色沉淀逐渐减少. 请用离子方程式表示出现上述颜色变化的原因。
①产生蓝色沉淀的离子方程式为,②后又变黑色沉淀的离子方程式为。
(4)铜是与人类关系非常密切的有色金属,已知常温下,在溶液中Cu2+稳定,Cu+易在酸性条件下发生;2Cu+=" Cu+" Cu2+。大多数+1价铜的化合物是难溶物,如:Cu2O、CuI、CuCl、CuH等。
①写出CuH在过量稀盐酸中有气体生成的离子方程式。
②将CuH溶解在适量的稀硝酸中,完成下列反应的化学方程式: