第四周期元素的单质及化合物在工农业生产中应用广泛。
(1)第四周期元素中,基态原子的最外层只有1个电子的元素共有 种。
(2)铂丝蘸取氯化钙在酒精灯上灼烧,火焰呈现砖红色,显色原因是 (填序号)。
| A.氯化钙受热挥发 | B.氯化钙受热分解 |
| C.钙离子中电子跃迁 | D.氯离子中电子跃迁 |
(3)无水硫酸铜呈白色,吸水后形成胆矾,呈蓝色。科学家通过X射线测定出胆矾的结构,其结构可用右图表示。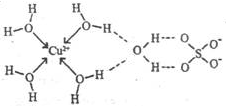
①胆矾晶体中除共价键、配位键及微弱的范德华力外,还存在的两种作用力是 和 。
②胆矾晶体CuSO4·5H2O可以写出[Cu(H2O)4]SO4·H2O,其中中心原子(离子)是 ,配体是 ,配位原子是 ,配位数是 。
③铜离子形成胆矾中配位离子的离子方程式为 。
(4)Mn、Fe均为第四周期过渡元素,两元素的部分电离能数据如右表。据表判断Mn2+和Fe2+再失去-个电子的难易,并从原子结构的角度筒述其原因 。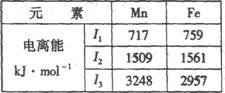
(8分)电池有干电池、蓄电池、燃料电池等。
(1)手电筒使 用的是普通锌-锰电池,请写出该电池工作时发生的
用的是普通锌-锰电池,请写出该电池工作时发生的
a.正极反应_____________________________________________________
b.电池总反应___________________________________________________ (2)汽车上使用的是Pb-PbO2-H2SO4构成的可反复使用的蓄电池,请写出该电池工作时
(2)汽车上使用的是Pb-PbO2-H2SO4构成的可反复使用的蓄电池,请写出该电池工作时
a.正极反应_________________________________________
b.电池总反应_________________________________________________
(8分)常温下,关于下列两个反应:
a.0.1mol/L醋酸溶液:CH3COOH  CH3COO-+H+
CH3COO-+H+
b.0.1mol/L醋酸钠溶液:CH3COO-+H2O  CH3COOH+OH-
CH3COOH+OH-
(1)两式到达平衡后,在a中加入一定量的水后,平衡向________________移动,溶液的pH______(填“升高”“降低”“不变”)
(2)向b中加入同浓度的醋酸钠溶液,溶液的pH将_______(填“升高”“降低”“不变”),若加入少量的CH3COOH,使溶液中c(Na+)=c(CH 3COO-),则溶液的pH为_______
3COO-),则溶液的pH为_______ (填数值)。
(填数值)。
(8分)在某温度时,把 0.5mol N2O4 气体通入体积为5L的密闭容器中,2s时NO2的浓度为0.02mol.L-1,60s时达到平衡,此时容器内的压强为开始时的1.6倍。试回答下列各问题:
(1)2s时用N2O4浓度变化表示的化学反应速率是_________________。
(2)2s时,体系内的压强为开始时的 ________倍,此时N2O4的分解率为_______。
( 3)达到平衡时,平衡混合物中N2O4的物质的量为____________,
3)达到平衡时,平衡混合物中N2O4的物质的量为____________,
(14分)
现有A、B、C、D、E、F六种短周期元素,A、E处于同一主族且E是短周期元素中原子半径最大的元素(不含稀有气体)。已知C的原子序数等于A、B的原子序数之和,D的原子序数等于A、C的原子序数之和。人类已知的化合物中,有一类化合物的种类已超过三千万,这类化合物中一般都含有A、B两种元素。F是一种生活中常用的金属。根据以上信息,回答下列问题:
(1)元素B在周期表中的位置是。
(2)F的 单质与E的最高价氧化物对应水化物反应的化学方程式是。
单质与E的最高价氧化物对应水化物反应的化学方程式是。
(3)C、D最低价氢化物稳定性的强弱顺序是(填化学式) ;D、E、F原子半径的大小顺序是(填元素符号)。
(4)在A、C、D组成的化合物中,既有离子键又有共价键的是(填化学式)。
(5)在A、B、D中,由两种或三种元素组成两种可以反应的阴离子,该反应的离子方程式是。
(6)化合物BA4D与O2、稀硫酸可组成燃 料电池,此电池的负极反应式是。
料电池,此电池的负极反应式是。
(16分)
运用化学反应原理研究氮、氧等元素的单质及其化合物的反应有重要意义。 Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)
Ⅰ.(1)一定温度和压强下,反应N2(g) + 3H2(g)  2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH(填“增大”、“减小”或“不改变”)。
2NH3(g)达到化学平衡状态。若向平衡体系中通入氩气,平衡(填“向左”、“向右”或“不”)移动;若使用活性更强的催化剂,该反应的ΔH(填“增大”、“减小”或“不改变”)。 (2)在一定温度和压强下,已知:
(2)在一定温度和压强下,已知:
O2 (g) = O2+ (g) + e-; H1=" 1175.7" kJ/mol
H1=" 1175.7" kJ/mol PtF6 (g) + e- = PtF6- (g);
PtF6 (g) + e- = PtF6- (g); H2=" ―771.1" kJ/mol
H2=" ―771.1" kJ/mol O2PtF6 (s) = O2+ (g) + PtF6- (g);
O2PtF6 (s) = O2+ (g) + PtF6- (g); H3=" 482.2" kJ/mol
H3=" 482.2" kJ/mol 则反应O2 (g) + PtF6 (g) = O2PtF6(s);
则反应O2 (g) + PtF6 (g) = O2PtF6(s); H="_____________" kJ/mol。
H="_____________" kJ/mol。 Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
Ⅱ.现有常温下的六种溶液:①0.01 mol/L CH3COOH溶液;②0.01 mol/L HCl溶液;③pH=12的氨水;④pH=12的NaOH溶液;⑤0.01 mol/L CH3COOH溶液与pH=12的氨水等体积混合后所得溶液;⑥0.01 mol/L HCl溶液与pH=12的NaOH溶液等体积混合所得溶液。
(1)⑤、⑥溶液比较,pH较大的是。
(2)六种溶液中,水的电离程度相同的是______________。
(3)若②、③混合后所得溶液pH=7,则消耗溶液的体积:②________ ③(选填“>”、“<”或“=”)。
(4)稀释相同倍数后,溶液的pH:①②,③④(选填“>”、“<”或“=”)。