已知Fe3+的氧化性强于I2,某澄清溶液中可能只含有以下离子中的若干种:Na+、Fe3+、Fe2+、SO、Cl-、Ba2+、I-.现取部分溶液依次进行如下实验:①通入一定量氯气后,加入CCl4振荡,静置后CCl4层呈紫红色,用分液漏斗分液;②向分液后的水溶液中加入足量硝酸酸化的硝酸钡溶液,产生白色沉淀;③过滤后将滤液分为两份,向一份中加入硝酸酸化的硝酸银溶液,产生大量沉淀,向另一份中 加入少量KSCN溶液,溶液立即变为红色.根据上述实验,以下推测正确的是 ( )
加入少量KSCN溶液,溶液立即变为红色.根据上述实验,以下推测正确的是 ( )
| A.无法确定原溶液中是否存在Cl-、Na+ |
B.原溶液 中肯定存在的离子有Fe3+、SO、I- 中肯定存在的离子有Fe3+、SO、I- |
| C.原溶液一定显中性 |
| D.原溶液中肯定不存在的离子有Fe2+、Ba2+ |
下列“能量——反应过程”曲线图能表示放热反应的是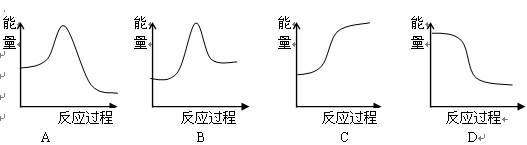
下列关于物质“反应程度”的说法正确的是
| A.一定条件下,2mol SO2与足量O2反应可得到2mol SO3 |
| B.含4mol HCl 的浓盐酸与足量的MnO2加热反应可制备1mol Cl2 |
| C.10ml 18.0 mol/L H2SO4与足量铜加热反应可制备0.09 mol SO2 |
| D.一定条件下,1mol N2与3 mol H2反应可制备1.0 mol NH3 |
甲:在试管中加入1 g粉末状大理石,加入4mol/L 盐酸20ml(过量);
乙:在试管中加入2 g颗粒状大理石,加入4mol/L 盐酸20ml(过量);
下列CO2生成体积(折算成标况)V(CO2)同反应时间t的关系曲线图合理是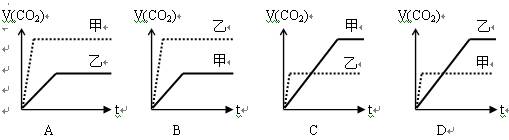
下列根据元素周期表以及元素周期律对“金属锶Sr及其化合物”进行推测或分析不合理的是
| 周期 |
IIA |
||||
| 2 |
Be |
||||
| 3 |
Mg |
||||
| 4 |
Ca |
||||
| 5 |
Sr |
||||
| 6 |
Ba
|
右图是短周期元素周期表的部分结构,A、B、C、D、E是其中的五种元素,下列说法错误的是
| …… |
|||||
| D |
C |
A |
|||
| E |
B |
A.元素非金属性比较:A>B>E
B.D元素原子L层电子数是K层电子数的2倍
C.A的最高价氧化物水化物分子式为HAO4
D.C最低价氢化物和B最低价氢化物反应生成离子化合物