电解100mL含c(H+)=0.30mol/L的下列溶液,当电路中通过0.04mol电子时,理论上析出金属质量最大的是
| A.0.20mol/L Cu2+ | B.0.02mol/L Zn2+ | C.0 .20mol/L Pb2+ .20mol/L Pb2+ |
D.0.10mol/LAg+ |
下列说法不正确的是
| A.热水瓶胆中的水垢可以用食醋除去 |
| B.可以用淀粉溶液检验加碘盐中是否含碘元素 |
| C.在蔗糖中加入浓硫酸出现黑色物质, 说明浓硫酸具有脱水性 |
| D.做红烧鱼时,常加一些食醋和酒会更香,是因为生成少量的酯 |
短周期元素R、X、Y、Z原子序数依次增大,其中R的气态氢化物的水溶液呈碱性,X是同周期中原子半径最大的元素,Y的单质是一种常见的半导体材料,Y与Z的原子序数相差3,下列判断正确的是
| A.最外层电子数:Z>R>Y |
| B.气态氢化物的稳定性:Y>Z |
| C.R、X的氧化物均为离子化合物 |
| D.X和Y两者最高价氧化物对应的水化物能相互反应 |
下列实验操作、现象和结论均正确的是
| 选项 |
操作 |
现象 |
结论 |
| A |
向FeSO4溶液中滴入少量酸性KMnO4溶液 |
KMnO4溶液紫色褪去 |
Fe2+有氧化性 |
| B |
向Na2SiO3溶液中通入适量的CO2 |
产生白色胶状物质 |
酸性:H2CO3>H2SiO3 |
| C |
将新制氯水和NaBr溶液在试管中混合后,加入CCl4,振荡,静置 |
下层溶液呈橙红色 |
氧化性:Cl2>Br2 |
| D |
向Al2(SO4)3溶液中滴加过量氨水 |
溶液先浑浊后澄清 |
Al3+与NH3·H2O不能大量共存 |
某小组为研究原电池原理,设计如图装置,下列叙述正确的是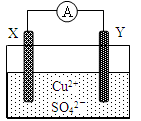
| A.若X为Fe,Y为Cu,铁为正极 |
| B.若X为Fe,Y为Cu,电子由铜片流向铁片 |
| C.若X为Fe,Y为C,碳棒上有红色固体析出 |
| D.若X为Cu,Y为Zn,锌片发生还原反应 |
设nA为阿伏加德罗常数的数值,下列说法正确的是
| A.0.1 mol·L-1Ba(OH)2溶液中含有0.2nA个OH- |
| B.1mol Na与足量水反应,转移2nA个电子 |
| C.常温常压下,22.4L乙烯含有nA个CH2=CH2分子 |
| D.常温常压下,46g NO2含有2nA个氧原子 |