(1)银锌电池广泛用做各种电子仪器的电源,其电极分别是Ag2O和锌,电解液为KOH溶液。工作时原电池的总反应是:Ag2O + Zn + H2O ="==" 2Ag + Zn(OH)2,根据上述变化判断:①原电池的正极是__________。②工作时原电池两极反应式为:
负极 ,正极
(2)用铜电极电解NaOH溶液,写出
①阳极的电极反应_____________________________________
②电解总反应_______________________________________
两个学习小组用如图装置(固定装置及胶皮管略去)探究乙二酸(HOOC—COOH)受热分解的部分产物。己知常温时CO+PdCl2+H2O==CO2↑+Pd↓(灰)+2HCl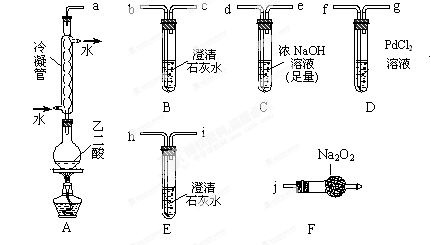
(1)甲组:
①按接口顺序:a-b-c-d-e-f-g-h连接装置进行实验。B中溶液变浑浊,证明分解产物有; E中溶液变浑浊,证明分解产物有。
②乙二酸受热分解的化学方程式为。
(2)乙组:
①将接口a与j连接进行实验,观察到F中生成的气体可使带火星的木条复燃,则F中最主要反应的化学方程式为。
②去掉冷凝管,将接口a与b连接进行实验, B中溶液变浑浊,但不能说明有欲检验的一种分解产物,理由为。
葡萄糖是人类的营养素,在体内富氧条件下被氧化生成二氧化碳和水,在缺氧条件下则生成一种有机酸A。
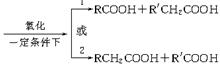
②将A进行如下图所示的反应,其中C和C′是同系物,C′是甲酸(HCOOH)。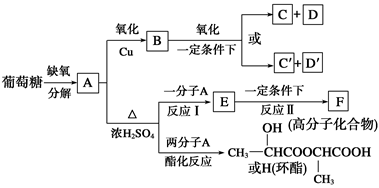
回答下列问题:
(1)C和D′属于_______(填序号,下同)。
①同系物 ②同分异构体 ③同类物质 ④同素异形体
(2)D′和E分别属于哪一类化合物:D′____,E___________。
①多元醇 ②醛 ③不饱和羧酸 ④多元羧酸 ⑤酯
(3)写出结构简式:A____________,F____________,H________________。
(4)写出反应类型:(Ⅰ)__________,(Ⅱ)__________。
(5)写出下列转化的化学方程式:
A―→B___________________________;A―→E_______________________________。
(1)某烃类化合物A的质谱图表明其相对分子质量为84,红外光谱表明分子中含有双键,核磁共振氢谱表明分子中只有一种类型氢。则分子式为,分子中所有碳原子是否全部在一平面上(填是、否)。
(2)在有机物分子中碳原子所连的4个原子或原子团均不相同时,该碳原子叫手性碳原子。右边有机物具有光学活性,试用*C标出手性碳原子。若要消除其光学活性,可选用下列哪些化学反应(填字母)a还原、b氧化、c消去、d酯化、e水解。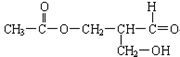
(3)某有机物的结构简式见右,等物质的量的该物质,消耗Na、NaOH、NaHCO3的物质的量之比为;消耗H2、Cu(OH)2、Br2(水)的物质的量之比为 。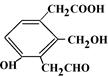
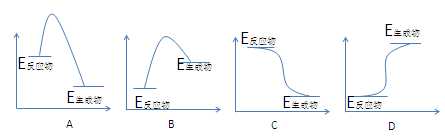
下面的四幅图与所给的四个反应有一一对应关系,请你找出来并填入下面的表格中:
①HCl + NaOH →NaCl + H2O + Q②H2 + Cl2 2HCl + Q
2HCl + Q
③CaCO3 → CaO + CO2↑ - Q④Ba(OH)2·8H2O → Ba(OH)2 + 8H2O – Q
| ① |
② |
③ |
④ |
(CN)2、(OCN)2、(SCN)2等通称为拟卤素,它们的性质与卤素相似,氧化性强弱顺序是:(OCN)2>Cl2>(CN)2>(SCN)2>I2,写出下列反应的方程式
(1)(OCN)2+ KI
(2)AgCN
(3)(SCN)2+ H2O