(16分) 图Ⅰ是实验室中常用于制备和干燥气体的装置: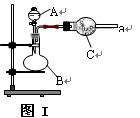
(1) 甲同学用图Ⅰ装置、铜和浓硝酸制备并收集干燥的NO2气体:
① B中反应的化学方程式__________ ___________________。
___________________。
② 收集NO2气体的方法 ;
③ 将收集满NO2的烧瓶密封浸入冰水中,烧瓶内气体颜色变浅,则下列反应:
2NO2 (g)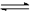 N2O4(g) ΔH 中的ΔH 0(填“>”或“<”)
N2O4(g) ΔH 中的ΔH 0(填“>”或“<”)
(2) 乙同学用图Ⅰ装置制取NH3和O2的混合气体,用图Ⅱ装置验证氨的某些性质:
往A中加入浓氨水,B中加入Na2O2固体,C中加入碱石灰,D内放置催化剂(铂石棉),按气流方向a→ b→c→ h连接各仪器 :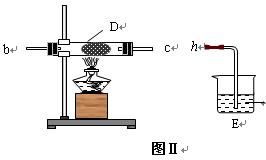
① 实验中观察到D内有红棕色气体出现,证明氨气具有____(填“氧化性”或“还原性”)。
② D中反应的化学方程式为________________ _____、 .
③为防止NO2 污染环境,E装置中装的试剂可以是 。
苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: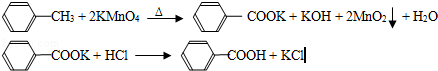
实验方法:一定量的甲苯和
溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.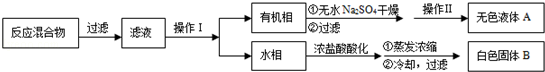
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3
和6.9
;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为,操作Ⅱ为.
(2)无色液体
是,定性检验
的试剂是,现象是
(3)测定白色固体
的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与
的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 |
实验方案 |
实验现象 |
结论 |
| ① |
将白色固体 加入水中,加热溶解, | 得到白色晶体和无色溶液 |
|
| ② |
取少量滤液于试管中, | 生成白色沉淀 |
滤液含 |
| ③ |
干燥白色晶体, | 白色晶体是苯甲酸 |
(4)纯度测定:称取1.220 产品,配成100 甲醇溶液,移取25.00 溶液,滴定,消耗 的物质的量为2.40×10﹣3 ,产品中苯甲酸质量分数的计算表达式为,计算结果为(保留二位有效数字).
碘在科研与生活中有重要作用,某兴趣小组用
、0.2%淀粉溶液、
、
等试剂,探究反应条件对化学反应速率的影响.
已知:
(慢)
(快)
(1)向
、
与淀粉的混合溶液中加入一定量的
溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,
与
初始的物质的量需满足的关系为:n(
):n(
).
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
| 实验 序号 |
体积V/ml |
||||
|
溶液 |
水 |
溶液 |
溶液 |
淀粉溶液 |
|
| ① |
10.0 |
0.0 |
4.0 |
4.0 |
2.0 |
| ② |
9.0 |
1.0 |
4.0 |
4.0 |
2.0 |
| ③ |
8.0 |
Vx |
4.0 |
4.0 |
2.0 |
表中Vx=ml,理由是.
(3)已知某条件下,浓度c(
)~反应时间t的变化曲线如图13,若保持其它条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(
)~反应时间t的变化曲线示意图(进行相应的标注).
(4)碘也可用作心脏起捕器电源﹣锂碘电池的材料,该电池反应为:
已知:
则电池反应的
=;碘电极作为该电池的极.
现拟用图所示装置(尾气处理部分略)来制取一氧化碳,并用以测定某铜粉样品(混有
粉末)中金属铜的含量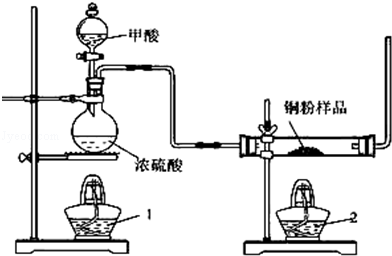
(1)制备一氧化碳的化学方程式是;
(2)试验中,观察到反应管中发生的现象是;尾气的主要成分是;
(3)反应完成后,正确的操作顺序为(填字母)
a.关闭漏斗开关 b.熄灭酒精1 c.熄灭酒精灯2
(4)若试验中称取铜粉样品5.0g,充分反应后,反应管中剩余固体的质量为4.8g,则原样品中单质铜的质量分数为;
(5)从浓硫酸、浓硝酸、蒸馏水、双氧水中选用合适的试剂,设计一个测定样品中金属铜质量分数的方案;
①设计方案的主要步骤是(不必描述操作过程的细节);
②写出有关反应的化学方程式.
实验室测定碳酸钠和碳酸氢钠混合物中碳酸钠的质量分数w(Na2CO3),称取此混合物5.0g,溶于水中,配成250mL溶液。
方案一:沉淀法。利用化学反应把HCO3-、CO32-完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中w (Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3-、CO32-完全转化为沉淀,应选用的试剂是___________(填编号)。
| A.CaCl2溶液 | B.MgSO4溶液 | C.NaCl溶液 | D.Ba(OH)2溶液 |
(2) 简述证明HCO3-、CO32-已完全沉淀的实验操作_________________________。
(3) 过滤,提取沉淀,则过滤操作所需要的玻璃仪器除烧杯外,还有________________________。
(4) 将沉淀洗涤,并充分干燥,称量沉淀的质量为mg,由此可以计算w(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得w (Na2CO3)________________(填偏大或偏小、无影响)。
方案二:量气法。量取10.00mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃,1.01×105Pa)的体积,由此计算混合物中w (Na2CO3)。
(1)装置中导管a的作用是。
(2)反应结束后,为了准确地测量气体体积,量气管在读数时应注意:
①_______________________________,
②_________________________________,
③眼睛视线与液面最低处相平。
(3)实验前后碱式滴定管中液面读数分别为V1 mL、V2 mL。则 产生CO2的体积为mL。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L盐酸进行滴定到终点(已知终点时反应H++CO32- =HCO3-恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择_______________仪器来完成。
(2)判断滴定终点的依据是_____________________。
(3)此法测得w(Na2CO3)=%。
(18分) (1)某实验小组的甲同学用图l所示装置制取少量乙酸乙酯(加热设备及夹持固定装置均略去)。


①试管a中需要加入浓硫酸、冰醋酸和乙醇各2mL,正确的加入顺序及操作是。
②试管a中加入碎瓷片的作用是,如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是(填序号)。
| A.立即补加 | B.不需补加 | C.冷却后补加 | D.重新配料 |
③实验中加热试管a的目的是:(i);(ii)。
④试管b中盛有饱和Na2CO3溶液,其作用是。
⑤反应结束后,振荡试管b,静置。观察到的现象是。
(2)该小组的乙同学利用图2所示装置制备并收集干燥的NO2气体。
①图2中仪器n的名称是。
②请在方框内画出用集气瓶收集NO2的装置图。
③写出仪器n中发生反应的离子方程式:。
(3)该小组的丙同学利用图2所示装置制取NH3和O2的混合气体,并且利用图3所示装置验证NH3的某些性质。m中加入浓氨水,q中加入碱石灰,e内放置催化剂(铂石棉),按气流方向连接各仪器x→y→z→h。
①图2仪器n内需加入固体试剂的名称为。
②实验中观察到e内有红棕色气体出现,证明氨气具有性,e中发生反应的化学方程式为。