实验室用NaOH固体配制500mL 1.2mol/L的NaOH溶液,请回答下列问题:
(1)需用托盘天平称取NaOH的质量 g。
(2)容量瓶上需标有以下五项中的 。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(3)配制时,其正确的操作顺序是(用字母表示)___________ __。
A.用30mL水洗涤烧杯2—3次,洗涤液均注入容量瓶,振荡
B.用天平准确称取所需NaOH的质量于烧杯中,加入少量水(约100mL),用玻璃棒慢慢搅拌,使其充分溶解
C.将已冷却的NaOH溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与容量瓶刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
G.检查容量瓶是否漏水
(4)下列操作会使所配制的溶液浓度偏低的是 (填字母)。
A.用称量纸称量NaOH固体
B.配制前容量瓶中有少量蒸馏水
C.溶液注入容量瓶前未冷却到室温
D.加蒸馏水定容时不慎超过了刻度线
E.定容时俯视刻度线
3名同学在用氯酸钾和二氧化锰混合加热制取氧气的过程中,发现生成的气体有刺激性气味,针对这一“异常现象”进行了实验探究及分析。
(1)甲用湿润的KI-淀粉试纸检验上述生成的气体,观察到试纸变蓝,据此判断氧气中混有Cl2。用离子方程式解释甲判断试纸变蓝的原因。
(2)乙认为上述现象只能说明混合气体具有性,实验中使试纸变蓝的气体单质还可能是。为了进一步验证甲的推测,乙补充了一个实验:将上述生成的气体冷却后通入盛有溶液的洗气瓶中,若现象为,则甲的推测合理。
(3)丙查阅文献获知,这种方法制取氧气的过程中确有Cl2产生,并且查到了以下反应历程:
①2KClO3 + 2MnO2 → 2KMnO4 + Cl2 + O2↑
②反应②
③K2MnO4 + Cl2 → 2KCl + MnO2 + O2↑
总反应 2KClO3→2KCl + 3O2↑
丙设计实验,通过观察MnO4-的特征颜色来验证反应历程中①的发生,具体实验操作为:将一定量的KClO3和MnO2混合于试管中,加热,。写出历程中反应②的化学方程式。
(4)另据文献记载:此法制取的氧气中除了含有Cl2,还混有化合物ClO2。ClO2具有强氧化性,可以将污水中的S2-氧化成SO42-,反应的离子方程式为。
根据侯德榜提出的工艺,制碱厂设计生产流程如下:
(1)该流程中可循环利用的物质是。向母液中通氨气,并加入细小食盐颗粒,冷却析出副产品,通氨气的作用有。
A.增大NH4+的浓度,使NH4Cl更多地析出
B.使NaHCO3更多地析出
C.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)检验产品纯碱中是否含有NaCl的试剂是。
(3)某学习小组在实验室模拟制碱有关工艺。
①若利用氯化铵和熟石灰制取氨气,反应方程式是,制得的氨气可用下列盛有NaCl溶液的装置吸收。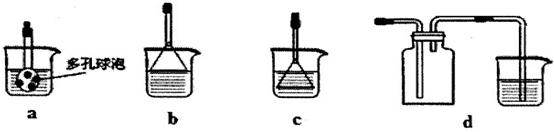
②已知用饱和NaNO2与NH4C1溶液加热可制取氮气。该小组模拟工业合成氨设计如下装置: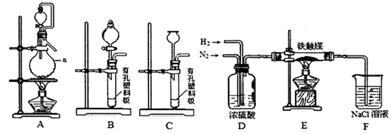
仪器a的名称是;氢气的发生装置应选用;A装置加热片刻后,即应移去酒精灯以防反应物冲出,其原因是。装置D的作用是①除去N2、H2中的水;②;③观察并调节气泡速率,控制N2、H2的比例。
有同学认为:从氨合成器(E装置)中出来的气体连续通入F装置的NaCl溶液中,可能会发生倒吸。你认为是否可能并说明理由。
草酸晶体的组成可表示为H2C2O4·xH2O。实验室常用其加热分解制取CO气体,反应方程式为:H2C2O4·xH2O  CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。
CO+CO2+(x+1)H2O。下图为分解草酸晶体,用干燥纯净的CO还原CuO制取Cu,并收集CO的实验装置(略去铁架台、铁夹等支撑加持装置),回答下列问题。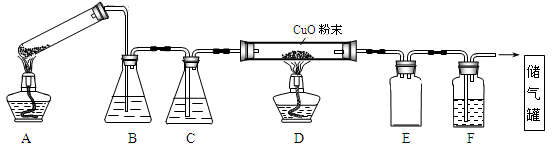
(1)A装置为加热分解草酸的装置,该装置错误是_________________,C装置中盛放的试剂是_______ (填化学式),E装置的作用是__________。
(2)实验过程中涉及到如下操作:
①点燃A处的酒精灯
②熄灭A处的酒精灯
③点燃D处的酒精灯
④熄灭D处的酒精灯。
这4步操作由先到后的顺序为_______(填序号)。点燃D处酒精灯前必须要进行的操作名称是__________。
(3)用酸性高锰酸钾溶液滴定草酸晶体,求x的值。
实验步骤:准确称取1.17g 草酸晶体,配成100mL溶液;取出20.00mL于锥形瓶中,再向瓶中加入足量稀H2SO4;用0.0500mol/L酸性高锰酸钾溶液滴定,滴定至终点时消耗高锰酸钾溶液16.00mL。滴定时,所发生的反应为:2MnO4-+5H2C2O4+6H+ = 10CO2+2Mn2++8H2O。
①配制草酸溶液除需要玻璃棒、烧杯,还一定需要的玻璃仪器有_____________。
②x=________。
(4)为探究催化剂对化学反应速率的影响,在甲乙试管中分别加入下列物质
| 试管 |
0.01mol/L KMnO4 |
0.1mol/L H2C2O4 |
0.1mol/L H2SO4 |
MnSO4固体 |
| 甲 |
4 mL |
x mL |
1 mL |
无 |
| 乙 |
y mL |
2mL |
1 mL |
有 |
则x=_______,y=________。能够得出催化剂对该反应有影响结论的实验现象是___________________。
下图是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。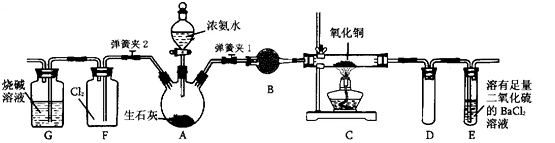
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先____,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹l,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时还可能产生的现象是________;从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。请写出产生白烟的化学方程式:________,迅速产生倒吸的原因是________。
(6)为了汪明一水合氨是弱碱,甲、乙两同学分别设计以下实验进行探究。
①甲同学用pH试纸测得室温下0.l mol/L氨水pH为10,则认定一水合氨是弱电解质,理由是________。
②乙同学取出10 mL 0.1 mol/L氨水,滴入2滴酚酞试液,显粉红色,再加入NH4Cl晶体少量,观察到的现象是________,则证明一水台氨是弱电解质。
【化学──选修2:化学与技术】
利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: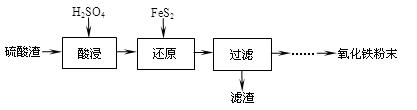
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率,②。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42-,该反应的离子方程式为。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:
准确量取一定体积的酸浸后的溶液于锥形瓶中,加入HCl、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62-,
Sn2++4Cl-+2HgCl2=SnCl62-+Hg2Cl2↓,
6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O。
①若SnCl2不足量,则测定的Fe3+量(填“偏高”、“偏低”、“不变”,下同)。
②若不加HgCl2,则测定的Fe3+量。
(4)①可选用(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是(用离子反应方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 |
Fe(OH)3 |
Al(OH)3 |
Fe(OH)2 |
Mg(OH)2 |
Mn(OH)2 |
| 开始沉淀 |
2.7 |
3.8 |
7.5 |
9.4 |
8.3 |
| 完全沉淀 |
3.2 |
5.2 |
9.7 |
12.4 |
9.8 |
实验可选用的试剂有:稀HNO3、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:;
b.沉淀:;
c.分离,洗涤;
d.烘干,研磨。