为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理经处理后钢铁零件表面生成Fe3SO4的致密的保护层——“发蓝”。主要反应如①②③:
①3Fe+NaNO2+5NaOH→3NaFeO2+NH3+H2O
②___Na2FeO2+____NaNO2+____H2O→ Na2Fe2O4+ NH3+ NaOH
③Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②,标出电子转移方向和数目。
(2)上述反应②中还原剂为 ,被还原物质是____ 。
若有1mol Na2Fe2O4生成,则反应中有____mol电子转移。
(3)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 。
硫酸铅(PbSO4)广泛应用于制造蓄电池、白色颜料等。利用锌冶炼过程中的铅浮渣生产PbSO4的流程如下:
已知铅浮渣的主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质。25℃时,Ksp(CaSO4)=4.9x10-5,Ksp(PbSO4)=1.6xl0-8。
(1)已知步骤I有NO气体产生,浸出液中含量最多的阳离子是Pb2+。分别写出PbO、Pb参加反应的化学方程式。
(2)步骤I需控制硝酸的用量并使Pb稍有剩佘,目的是。
(3)母液可循环利用于步骤I,其溶质主要是(填一种物质化学式),若母液中残留的SO42-过多,循环利用时可能出现的问题是。
(4)产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是除去。
(5)铅蓄电池的电解液是硫酸,充电后两个电极上沉积的PbSO4分别转化为PbO2和Pb,充电时阴极的电极反应式为。
许多硫的含氧酸盐在医药、化工等方面有着重要的用途。
(1))重晶石(BaS04)常作胃肠道造影剂。
已知:常温下,Ksp(BaSO4)=1.1×10-10,向BaSO4悬浊液中加入硫酸,当溶液的pH=2时, 溶液中 c(Ba2+)=。
(2)硫酸亚铁铵晶体[(NH4)2Fe(SO4)2·6H20]常作分析剂。
①检验晶体中含有NH4+的方法为_______。
②等物质的量浓度的四种稀溶液:
a.(NH4)2Fe(SO4)2b.NH4HSO4c.(NH4)2SO4d.(NH4)2SO3
其中C(NH4+)由大到小的顺序为(填选项字母)。
(3)过二硫酸钾(K2S2O8)常作强氧化剂,Na2S2O3常作还原剂。
①K2S2O8溶液与酸性MnSO4溶液混合,在催化剂作用下,可以观察到溶液变为紫色, 该反应的离子方程式为
②用铂作电极,电解H2SO4和K2SO4的混合溶液可以制备K2S2O8,其阳极的电极反应式为_______电解过程中阴极附近溶液的pH将______ (填“增大”、“减小”或“不变”)
③产品中K2S2O8的含量可用碘量法测定。操作步骤为:称取0.3g产品于碘量瓶中,加50 mL水溶解;加入4.000 g KI固体(稍过量),振荡使其充分反应;加入适量醋酸溶液酸化,以______为指示剂,用0.1000 mol·L-1 Na2S2O3标准液滴定至终点(已知:I2+2S2O32-=2I-+S4O62-)。重复2次,测得平均消耗标准液21.00mL。该产品中K2S2O8的质量分数为(杂质不参加反应)(列式并计算)。
最近几年我国已加大对氮氧化物排放的控制力度。消除氮氧化物污染有多种方法。
(l)用CH4还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H=-574kJ·mol-1
②CH4(g)+4NO (g)=2N2(g)+CO2(g)+2H2O(g) △H=-1160kJ·mol-1
③H2O(g)= H2O(l)△H=-44.0kJ·mol-1
CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(1)的热化学方程式为。
(2)用活性炭还原法也可处理氮氧化物。有关反应为:2C(s)+2NO2(g)=N2(g)+2CO2(g) △H<0,起始时向密闭容器中充入一定量的C(s)和NO2(g),在不同条件下,测得各物质的浓度变化状况如下图所示。
①0〜10min内,以CO2表示的平均反应速率v(CO2)=。
②0~10min,10〜20 min,30〜40 min三个阶段NO2的转化率分别为α1、α2、α3,其中最小的为,其值是。
③计算反应达到第一次平衡时的平衡常数K=。
④第10min时,若只改变了影响反应的一个条件,则改变的条件为(填选项字母)。
A.增加C(s)的量 B.减小容器体积 C.加入催化剂
⑤20~30min、40〜50 min时体系的温度分别为T1和T2,则T1_____T2(填“> “<”或“=”), 判断的理由是。
芳香化合物A、B互为同分异构体,B的结构简式是CH3COO- -COOCH2CH3,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示:
-COOCH2CH3,A经①、②两步反应得C、D和E,B经①、②两步反应得E、F和H。上述反应过程、产物性质及相互关系如下图所示: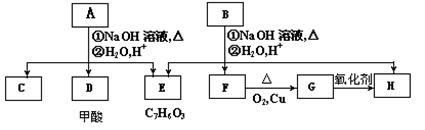
(1)B可以发生的反应类型有(填序号)。
①加成反应 ②酯化反应 ③消去反应 ④取代反应 ⑤聚合反应
B的核磁共振氢谱中会出现_______个峰。
(2)E中含有官能团的名称是。
(3)A有两种可能的结构,其对应的结构简式为,。
(4)B、C、D、F、G化合物中互为同系物的是。
(5)F与H在浓硫酸作用下加热时发生反应的方程式为:
。
硅是带来人类文明的重要元素之一,从传统材料到信息材料的发展过程中创造了一个又一个奇迹。
(1)硅在元素周期表中的位置是_______。
(2)工业生产粗硅的反应有:SiO2+2C Si(粗)+2CO↑,SiO2+3C
Si(粗)+2CO↑,SiO2+3C SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为。
SiC+2CO↑。若产品中单质硅与碳化硅的物质的量之比为1:1,则参加反应的C和SiO2的质量之比为。
(3)工业上可以通过如下图所示的流程制取纯硅:
①若反应I为 Si(粗)+3HCl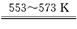 SiHCl3+H2,
SiHCl3+H2,
则反应II的化学方程式为。
②整个制备过程必须严格控制无水无氧。SiHCl3遇水剧烈反应生成H2SiO3、HCl和另 一种物质,写出该反应的化学方程式:。
③假设每一轮次制备1mol纯硅,且生产过程中硅元素没有损失,反应I中HCl的利用率为90%,反应II中H2的利用率为93.75%,则在第二轮次的生产中,补充投入HCl 和H2的物质的量之比是。