硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外研究小组测定该补血剂中铁元素的含量,实验步骤如下:
请回答下列问题:
(1)证明步骤①滤液中含有Fe2+的方法是先滴加KSCN溶液,再滴加 ,该过程的现象为: 。
(2)步骤②加入过量H2O2的目的: 。
(3)步骤③中反应的离子方程式: 。
(4)步骤④中一系列处理的操作步骤:过滤、 、灼烧、 、称量。
(5)若实验无损耗,则每片补血剂含铁元素的质量 g。
(6)该小组有些同学认为用KMnO4溶液滴定也能进行铁元素含量的测定。
(5Fe2++MnO—4+8H+→5Fe3++Mn2++4H2O)
①实验前,首先要精确配制一定物质的量浓度的KMnO4溶液250mL,配制时需要的仪器除天平、玻棒、烧杯、胶头滴管外,还需
②上述实验中的KMnO4溶液需要酸化,用于酸化的酸是____。
a.稀硝酸 b.稀硫酸 c.稀盐酸 d.浓硝酸
③滴定到终点时的颜色为 色。
(7)正常人每天应补充14mg左右的铁。其中绝大部分来自于食物。如果全部通过服用含FeSO4·7H2O的片剂来补充铁,则正常人每天服需用含 mg FeSO4·7H2O的片剂。
(14分)以下四组装置在下列实验可供选择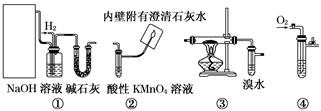
Ⅰ.实验室用甲醇催化氧化法得到甲醛,并验证甲醛的性质。请回答下列问题:
(1)应选择的装置是___ _____(填写编号)。
(2)若③硬质玻璃管中装有铜粉,请写出硬质玻璃管中发生反应的化学方程式___________________
(3)实验结束后,观察到溴水褪色。为解释这一现象,某学习小组的同学提出两种猜想:
A. 发生了加成反应; B. 发生了氧化反应。
为探究哪种猜想正确,学习小组的同学用pH计测溴水褪色前后溶液的pH,测得溶液的pH下降,你认为发生何种反应,请说出你的理由________________。
Ⅱ.若选择①③②验证乙烯与氢气反应产物,请回答下列问题:
(4)写出实验室制乙烯的化学方程式_______________________________________。
(5)NaOH溶液的作用是(答两点即可)____________、_。
(6)实验过程中,发现③中溴水褪色,试用化学方程式表示溴水褪色的原因______________;
(7)出现什么现象可说明乙烯与氢气反应生成了乙烷 _____________________________________。
(14分)利用下图装置进行木炭粉和浓硫酸的反应及其产物的检验。
已知:紫红色的酸性高锰酸钾溶液能与二氧化硫发生氧化还原反应,向酸性高
(1)组装好上述装置后,首先要进行的操作是:。
(2)写出浓硫酸和木炭粉在加热条件下发生反应的化学方程式:。
(3)用图中的装置检验上述反应的全部产物,写出下面标号所表示的仪器中应加入试剂的名称及其作用:A中加入的试剂和作用是、;B中加入的试剂和作用是、。
(4)实验时,C中应观察到什么现象,才可以说明生成了二氧化碳:。
碘溶于碘化钾溶液中形成I3—,并建立如下平衡:I3— I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
I—+ I2。实验室可以通过氧化还原滴定法测定平衡时I3—的浓度
实验原理:
为了测定平衡时的c(I3—) ,可用过量的碘与碘化钾溶液一起摇动,达平衡后取上层清液用标准的Na2S2O3滴定:2 Na2S2O3 + I2 =" 2NaI" + Na2S4O6。
由于溶液中存在I3— I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
I— + I2的平衡,所以用硫代硫酸钠溶液滴定,最终测得的是I2和I3—的总浓度,设为c1,c1 = c(I2)+c(I3—);c(I2) 的浓度可用相同温度下,测过量碘与水平衡时溶液中碘的浓度代替,设为c2,则c(I2)= c2,c(I3—)=c1 —c2;
实验内容:
1.用一只干燥的100 mL 碘量瓶和一只250 mL碘量瓶,分别标上1、2号,用量筒取80 mL 0.0100 mol.L-1 KI于1号瓶,取200 mL 蒸馏水于2号瓶,并分别加入0.5 g过量的碘。
2.将两只碘量瓶塞好塞子,振荡30分钟,静置。
3.分别取上层清液20 mL用浓度为c mol/L标准Na2S2O3溶液进行滴定。1号瓶消耗V1 mL Na2S2O3溶液,2号瓶消耗V2 mL Na2S2O3溶液。
4.带入数据计算c(I3—)
试回答下列问题
(1)标准Na2S2O3溶液应装入(填“酸式滴定管”或“碱式滴定管”),原因是。
(2)碘量瓶在震荡静置时要塞紧塞子,可能的原因是
(3)滴定时向待测液中加入的指示剂是,到达滴定终点时的现象为。
(4)用c 、V1和V2表示c(I3—)为mol·L-1。
(5)若在测定1号瓶时,取上层清液时不小心吸入了少量的I2固体,则测定的c(I3—)(填“偏大”、“偏小”或“不变”)
学习小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料: 该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其它成分遇到盐酸时无气体生成。
Ⅰ.摩擦剂中氢氧化铝的定性检验:取适量牙膏样品,加水搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤。氢氧化铝与NaOH溶液反应的离子方程式是______________。
(2)往(1)所得滤液中先通入过量二氧化碳,再加入过量稀盐酸。观察到的现象是________________。
Ⅱ.牙膏样品中碳酸钙的定量测定:利用下图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。
依据实验过程回答下列问题:
(3)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有______
(4)C中反应生成BaCO3的化学方程式是__________________________
(5)下列各项措施中,不能提高测定准确度的是_________(填标号)。
A.在加入盐酸之前,应排净装置内的CO2气体;
B.滴加盐酸不宜过快;
C.在A—B之间增添盛有浓硫酸的洗气装置
D.在B—C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(6)实验中准确称取8.00g样品三份,进行三次测定,测得BaCO3平均质量为3.94g。则样品中碳酸钙的质量分数为_________。
(7)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,一样可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是______________。
(16分)某研究小组取足量形状、质量均相同的铝片,分别与浓度均为6 mol•L-1的等体积的盐酸、氢氧化钠溶液充分反应后,取出剩余的铝片洗净、干燥、称量。
(1)上述反应剩余铝片的质量,前者________后者(填“大于”或“小于”或“等于”)。
(2)观察铝片与盐酸反应后的溶液较浑浊,且试管底部有少量黑色固体。
查资料已知:
①铝与盐酸反应,因反应过快而变成粉末分散到溶液中,形成黑色固体
②电解法冶炼铝所用的原料氧化铝是从铝土矿中提取的,氧化铝中往往还含有微量的氧化铁和二氧化硅杂质。写出在电解池中生成的铝与杂质二氧化硅反应的化学方程式: ________。
(3)为探究(2)中黑色固体的成分,提出合理假设。
假设1:黑色固体是Al和Fe
假设2:黑色固体是Al和Si
假设3:黑色固体是Al和_______________
(4)设计实验方案,基于假设3进行实验,验证黑色固体含有Al之外的其它成分。
限选实验试剂:蒸馏水、6mol·L-1H2SO4溶液、6mol·L-1NaOH溶液、6mol·L-1氨水、0.01mol·L-1KMnO4溶液、新制氯水、20%KSCN溶液。
| 实验步骤 |
预期实验现象和结论 |
| 步骤1:将反应所得浊液过滤、洗涤,取少量固体于试管中,加入足量的6mol·L-1 H2SO4溶液,充分振荡,静置。 |
___________________________________, 证明黑色固体含有Si |
| 步骤2: |
(5)已知硅与NaOH溶液反应与铝相似。取m1g黑色固体加足量NaOH溶液充分溶解,滤去不溶物(不考虑可溶物的损失),配成250mL溶液,取出25.00mL溶液,按下列操作进行实验: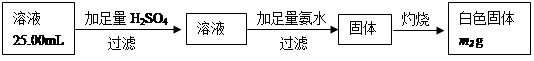
在上述操作中,需要用到的玻璃定量仪器有________________________________;
计算黑色固体中Al的质量分数为__________________(相对原子质量:Al-27 Fe-56 H-1 O-16)。