某化学小组欲探究铁及其化合物的氧化性和还原性,请回答下列问题:
(1)除胶头滴管外,你认为本实验必不可缺少的一种玻璃仪器是 。
(2)请帮他们完成以下实验报告:
实验目的:探究铁及其化合物的氧化性和还原性。
试剂:铁粉、FeCl3溶液、FeCl2溶液、氯水、锌片、铜片。
实验记录(划斜线部分不必填写):
| 序号 |
实验内容 |
实验现象 |
离子方程式 |
实验结论 |
| ① |
在FeCl2溶液中滴入适量氯水 |
溶液由浅绿色变为棕黄色 |
|
Fe2+具有还原性 |
| ② |
在FeCl2溶液中加入锌片 |
 |
Zn+Fe2+=Zn2++Fe |
|
| ③ |
在FeCl3溶液中加入足量铁粉 |
|
Fe+2Fe3+=3 Fe2+ |
Fe3+具有氧化性 |
| ④ |
|
 |
|
Fe3+具有氧化性 |
实验结论: 。
(3)根据以上结论判断,下列物质中既有氧化性,又有还原性的有: 。(填序号)
| A.Cl2 | B.Na | C.Na+ | D.Cl- E.SO2 F.NO2 |
(4)亚铁盐在溶液中易被氧化,而实验室中需要纯净的亚铁盐溶液。那么保存亚铁盐溶液时应该如何防止亚铁盐被氧化 。
某研究性学习小组将一定浓度Na2CO3溶液滴入CuSO4溶液中得到蓝色沉淀。
甲同学认为沉淀可能是CuCO3;乙同学认为沉淀可能是Cu(OH)2;
丙同学认为沉淀可能是CuCO3和Cu(OH)2的混合物。(查阅资料知:CuCO3和Cu(OH)2均不带结晶水)
Ⅰ.(1)乙同学的观点,你认为其原理是(用离子方程式表示):
。
(2)在探究沉淀成分前,须将沉淀从溶液中过滤、洗涤、低温干燥,检验沉淀是否洗涤干净的方法是。
Ⅱ.请用下图所示装置,选择必要的试剂,定性探究生成物的成分。
(3)B装置中试剂的化学式是, C装置中试剂的名称是。
(4)能证明乙同学观点正确的实验现象是。
(5) 若丙同学的观点正确,用上述装置通过B、C中质量的增加来定量测定沉淀的组成,该装置主要存在的缺点是。
海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如下图: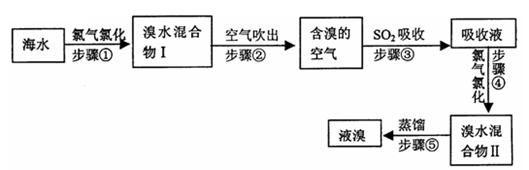
(1)步骤①反应的离子方程式是
(2)步骤③反应的化学方程式是
(3)Br的原子序数是,在周期表中位于周期族。
(4)步骤⑤蒸馏的过程中,温度应控制在80~90℃。温度过高或过低都不利于生产,请解释原因。
(5)为什么不直接用“溴水混合物I”而要用“溴水混合物II”进行蒸馏,得到液溴?
海洋植物如海带、海藻中含有丰富的碘元素,碘元素以碘离子的形式存在。实验室里从海带中提取碘的流程如下: 
⑴指出提取碘的过程中有关的实验操作名称:①;④。
写出过程②中有关反应的离子方程式。
⑵现有下列实验仪器:A.烧杯 B.漏斗 C.表面皿 D.分液漏斗E.酒精灯
步骤①中必须用到的有(填序号),还缺少的玻璃仪器有;
(3) 步骤③中不可选用的有机试剂是。
A.汽油. B.苯C.酒精D.四氯化碳
⑷步骤③的实验操作可分解为如下几步:(A)把盛有溶液的分液漏斗放在铁架台的铁圈中;(B)把50毫升碘水和15毫升CCl4加入分液漏斗中,并盖好玻璃塞;(C)检验分液漏斗活塞和上口的玻璃塞是否漏液; (D)倒转漏斗用力振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正; (E)旋开活塞,用烧怀接收溶液;(F)将分液漏斗上口倒出上层水溶液;(G)将漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准漏斗口上的小孔;(H)静置,分层; 就此实验,完成下列填空:
①正确操作步骤的顺序是:(用上述各操的编号字母填写)
→→→A→G→→E→F
②上述(E)步骤的操作中应注意
上述(G)步骤操作的目的是
(5)请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法。
如下图所示实验室制取酚醛树脂的装置,按要求填写下列空白:
(1)长玻璃管的作用除导气连通外还有。
(2)此反应需水浴加热,为什么不用温度计控制水浴温度?
(3)写出实验室制取酚醛树脂的化学方程式(有机物用结构简式):
。
“酒是陈的香”,就是因为酒在储存过程中生成了有香味的乙酸乙酯,在实验室我们也可以用如右图所示的装置制取乙酸乙酯。回答下列问题:
(1)写出制取乙酸乙酯的化学方程式
(2)在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合液的方法是:在大试管中先加入,然后边摇动试管边慢慢加入,待稍冷却后再加入乙酸。
(3)浓硫酸的作用是:① ;② ,
(4)饱和碳酸钠溶液的主要作用是①
②。
(5)装置中通蒸气的导管要插在饱和碳酸钠溶液的液面上,不能插入溶液中,目的是 。
(6)若要把制得的乙酸乙酯分离出来,应采用的实验操作是 。